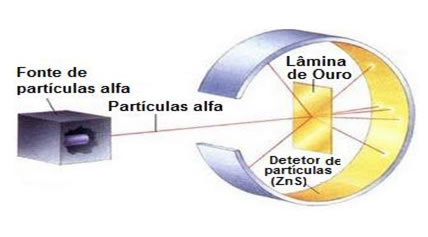
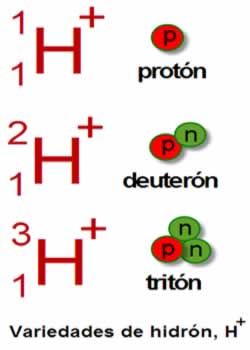
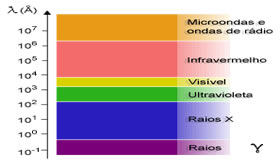
Do século XIX em diante, a teoria atômica foi retomada por cientistas como Dalton, Thomson, Rutherford e Böhr. Esses e outros cientistas causaram uma verdadeira evolução no modelo atômico e na forma de compreender a constituição da matéria.
Vários fenômenos foram explicados e interpretados graças à compreensão da estrutura dos átomos. Além disso, esse conhecimento propiciou o desenvolvimento de várias áreas da sociedade.
Nesta subseção, serão analisadas detalhadamente todas as descobertas sobre a estrutura atômica.