Por volta de 450 a.C., os filósofos Leucipo e Demócrito elaboraram uma teoria que afirmava que se todos os compostos fossem divididos infinitamente, em um determinado momento não se poderia dividir mais a matéria, pois tudo seria composto de minúsculas partículas indivisíveis. Eles deram a essas partículas o nome de átomo (do grego, a: não; tomo: divisível).
Com a evolução da ciência e o uso de experimentos, os cientistas começaram a determinar certas leis relacionadas a alguns fenômenos que ajudaram a desenvolver melhor esse conceito. A seguir estão listadas as teorias mais estudadas:
1º) Modelo atômico de Dalton (“modelo da bola de gude”)
O primeiro cientista que retomou essa teoria de Demócrito e Leucipo foi John Dalton (1766-1844), no ano de 1803. Baseado em experiências e nas leis ponderais de Proust (Lei das proporções constantes) e de Lavoisier (Lei de conservação das massas), ele formulou o primeiro modelo* atômico, que dizia sucintamente o seguinte:
“Toda matéria é formada por átomos, que são partículas maciças, esféricas e indivisíveis, e um átomo de um elemento se diferencia do outro somente pela mudança nos tamanhos e nas massas.”

Cientista John Dalton e seu modelo atômico
2º) Modelo atômico de Thomson (“modelo do pudim de passas”)
Com o estudo das características elétricas da matéria, J.J.Thomson (1856-1940) realizou em 1887 um experimento com um feixe de raios catódicos e descobriu partículas negativas que eram atraídas pelo polo positivo de um campo elétrico externo.
Dessa forma, ele concluiu que o átomo deveria conter uma partícula subatômica negativa, denominada de elétron. Assim, caiu por terra a teoria de Dalton de que o átomo seria indivisível. Seu modelo atômico foi o seguinte:
“O átomo é uma esfera de carga elétrica positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula”.

Cientista J.J.Thomson e seu modelo atômico
3º) Modelo atômico de Rutherford (“modelo do sistema solar”)
Com a descoberta da radioatividade, as pesquisas sobre a constituição da matéria puderam ser mais exploradas. Enerst Rutherford (1871-1937) realizou em 1911 um experimento com partículas alfa (α), no qual tentou verificar se os átomos realmente eram maciços. Ao final do experimento, os resultados obtidos mostraram que o átomo contém imensos espaços vazios e um núcleo positivo, onde ficavam os prótons (partículas subatômicas positivas). Portanto, o modelo de Rutherford é enunciado assim:
“O átomo é constituído de duas regiões distintas: um núcleo ou região central que contém praticamente toda a massa do átomo e apresenta carga positiva; e uma eletrosfera, isto é, uma região ao redor do núcleo, onde os elétrons giram em órbitas circulares”.
Com a descoberta da terceira partícula subatômica, o modelo de Rutherford passou a incluir os nêutrons (partículas sem carga elétrica) no núcleo.

Cientista Ernest Rutherford e seu modelo atômico
4º) Modelo atômico de Rutherford-Böhr
Se o átomo fosse como Rutherford propunha, os elétrons adquiririam um movimento em espiral e colidiriam com as partículas positivas do núcleo, além disso, eles perderiam energia em forma de radiação. Assim, em 1913 foi criado um novo modelo atômico pelo Químico Niels Böhr (1885-1962), que, apesar de revolucionário, mantinha as principais características do modelo de Rutherford. De maneira que este modelo passou a ser chamado de modelo atômico de Rutherford-Böhr e enunciava:
“O átomo pode ser representado de forma que as órbitas permitidas para os elétrons tenham relação com os diferentes níveis de energia e, ainda, com as respectivas raias presentes no espectro característico de cada elemento químico.”
Desse modo, cada órbita circular permitida para os elétrons possuem energias diferentes, constantes e determinadas; sendo denominadas de níveis de energia.
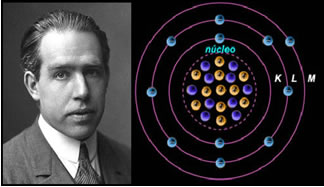
Cientista Niels Böhr com seu modelo atômico, que aperfeiçoou o modelo de Rutherford.
*Modelo é uma imagem mental que explica a teoria de algum fenômeno que não pode ser visualizado diretamente. Ele serve para ilustrar a teoria, mas não quer dizer que fisicamente exista ou que seja exatamente igual ao fenômeno relatado. Assim, o modelo do átomo não é o próprio átomo, mas serve para explicar sua constituição, propriedades e comportamento.