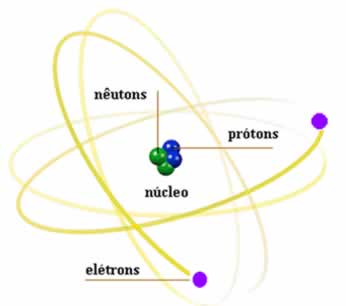
Um átomo é composto por duas regiões básicas: o núcleo (região central) e as eletrosferas (localizadas em volta do núcleo). A eletrosfera mais distante do núcleo é denominada de camada de valência.
As eletrosferas são níveis de energia ou camadas eletrônicas. Se um átomo apresenta três eletrosferas (K, L e M), por exemplo, sua camada de valência será a terceira, ou seja, o nível M.
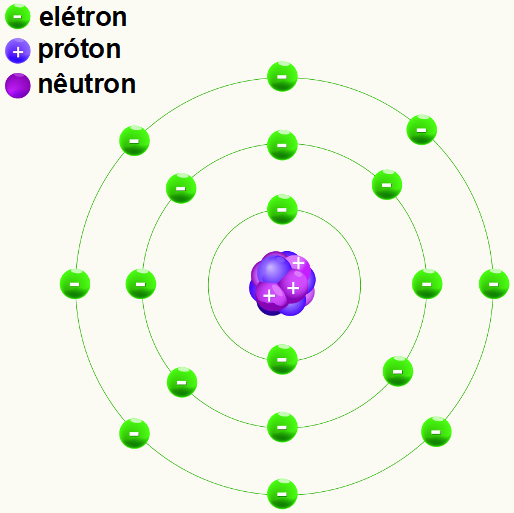
Níveis de um átomo do elemento argônio
Agora, de que forma podemos determinar a camada de valência de um átomo? Há algumas maneiras possíveis, detalhadas a seguir:
-
Tópicos deste artigo
- 1 - Utilizando a tabela periódica
- 2 - Exemplos com a Tabela Periódica
- 3 - Exemplos com distribuição eletrônica
Utilizando a tabela periódica
Para encontrar a camada de valência utilizando a tabela periódica, basta analisar o período (coluna horizontal) em que o elemento químico está. Na tabela, existem sete períodos:
Obs.: Vale ressaltar que os elementos da série dos lantanídeos (coluna horizontal e de cor verde) estão no 6o período ao passo que os da série dos actinídeos (coluna horizontal e de cor azul) estão no 7o período.
O período em que o elemento químico está na tabela periódica indica exatamente o número de níveis que seus átomos apresentam e, consequentemente, mostra o número da sua última camada, ou seja, a camada de valência. Acompanhe alguns exemplos:
Exemplos com a Tabela Periódica
-
Arsênio (As)
O elemento arsênio está localizado no 4o período da tabela, logo, seus átomos possuem um total de quatro níveis. Como o último nível é a camada de valência, no caso desse elemento, ela será a 4a camada.
-
Ósmio (Os)
O elemento ósmio está localizado no 6o período da tabela, logo, seus átomos possuem um total de seis níveis. Como o último nível é a camada de valência, no caso desse elemento, ela será a 6a camada.
-
Hélio (He)
O elemento hélio está localizado no 1o período da tabela, logo, seus átomos possuem apenas um nível, que é a sua camada camada de valência.
Exemplos com distribuição eletrônica
Para determinar a camada de valência de um átomo por meio da distribuição eletrônica, basta utilizar o número atômico no diagrama de Linus Pauling, como nos exemplos abaixo:
-
Estrôncio (Z = 38)

Distribuição eletrônica do estrôncio
Analisando a distribuição eletrônica do estrôncio, observamos que o quinto nível é o mais afastado do núcleo. Por isso, sua camada de valência é a 5a.
-
Férmio (Z = 100)

Distribuição eletrônica do férmio
Analisando a distribuição eletrônica do férmio, observamos que o sétimo nível é mais afastado do núcleo. Por isso, sua camada de valência é a 7a.
Aproveite para conferir nossa videoaula sobre o assunto:


.jpg)