*Número Atômico (Z): Se refere à quantidade de cargas positivas (prótons) existentes no núcleo de um átomo. Em 1913, o cientista inglês Moseley (1887-1975) propôs exatamente isso: o comportamento diferente de cada tipo de átomo está relacionado com a quantidade de cargas positivas.
Z = PRÓTONS
Exemplo:
Cloro (Cl) Z= 17 (isto significa que o átomo de cloro possui 17 prótons no núcleo e, consequentemente, 17 elétrons; pois os átomos são eletricamente neutros, tendo a mesma quantidade de carga positiva e negativa).
*Número de Massa (A): É a soma das partículas nucleares, ou seja, do número atômico (Z) ou prótons com a quantidade de nêutrons existentes no núcleo.
A = Z + n ou A = p + n
Exemplo 1: O átomo de sódio (Na) possui 11 prótons, 11 elétrons e 12 nêutrons. Determinar seu número de massa (A):
A = p + n → A = 11 + 12 → A =23
Resposta: O número de massa do sódio é 23.
Exemplo 2: O elemento cálcio possui número atômico 20 e número de massa igual a 40. Quantos nêutrons possui este átomo?
A = Z + n → n = A - Z → A = 40 - 20 → A = 20
Resposta: Existem 20 nêutrons no núcleo do átomo de cálcio.
Obs.: O número de massa não é uma massa, mas, serve apenas para indicar a quantidade de partículas do átomo cuja massa é relevante. Pois a massa do elétron é insignificante, sendo 1/1836 vezes menor que as massas relativas do próton e do nêutron.
*Elemento Químico: É o conjunto de átomos de mesmo número atômico.
Todos os elementos químicos até então conhecidos, estão transcritos na Tabela Periódica. Os números atômicos correspondentes são também alistados, seguindo uma ordem crescente de número atômico na Tabela.
Um elemento Químico é representado colocando-se no centro seu símbolo, na parte de cima o número de massa (A) e na parte de baixo o número atômico, conforme mostrado a seguir com um elemento genérico X.
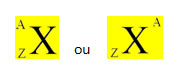
Exemplos:
![]()
No entanto, na Tabela Periódica não é seguida esta representação. No lugar do número de massa, aparece a respectiva massa atômica de cada elemento, que são as médias ponderadas das massas atômicas dos isótopos naturais do elemento.
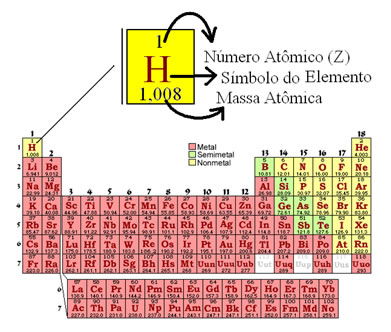
Cada elemento representado na Tabela Periódica vem acompanhado de seu respectivo Número Atômico
Aproveite para conferir nossas videoaulas relacionadas ao assunto: