Cada elétron que fica na eletrosfera do átomo pode ser caracterizado por meio de quatro códigos matemáticos que indicam a energia desse elétron. Esses quatro códigos são chamados de números quânticos e são eles: principal, secundário (ou azimutal), magnético e de spin.
Nunca haverá dois elétrons ou mais com os mesmos quatro números quânticos.
Veja o que indica cada um deles:
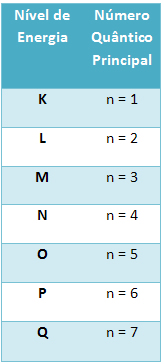
- Número Quântico Principal (n):
Indica o nível de energia do elétron, variando de 1 a 7. Quanto maior o número quântico principal, maior será a energia do elétron.
- Número Quântico Secundário ou Azimutal (?):
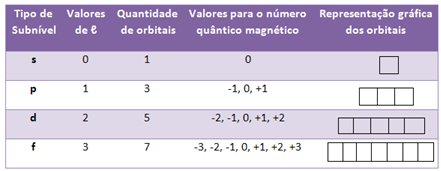
Indica o subnível de energia do elétron, que até o momento varia apenas de zero a 3, conforme os subníveis indicados abaixo:
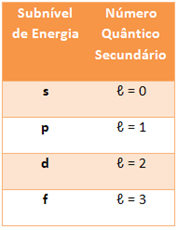
Isso significa que para um número quântico principal n, o número quântico secundário será ? = n - 1.
- Número Quântico Magnético (m ou m?):
Indica a orientação dos orbitais no espaço. Um orbital é a região do espaço ao redor do núcleo atômico onde é maior a probabilidade de se encontrar determinado elétron.
Cada subnível de energia apresenta uma determinada quantidade de orbitais e cada orbital apresenta um formato característico e uma orientação espacial específica. Além disso, geralmente representamos um orbital por um quadrado (?).
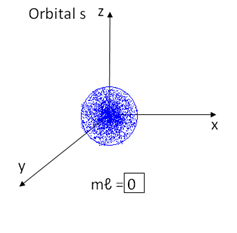
Por exemplo, os orbitais do tipo s possuem uma forma esférica e, portanto, só é possível uma orientação espacial, sendo representados por apenas um quadrado:
Já os orbitais do tipo p possuem o formato de duplo ovoide e, dessa forma, podem ter três orientações no espaço, sendo representados por três quadrados, com valores que vão de -1 a +1:
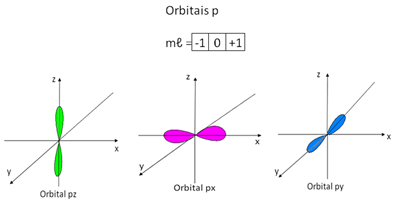
Dessa forma, temos as seguintes possibilidades de valores para os números quânticos magnéticos:
- Número Quântico Spin (s ou ms):
Indica o sentido da rotação do elétron. Cada elétron comporta-se como um pequeno ímã, pois eles podem girar num mesmo sentido ou em sentidos opostos e, desse modo, criar campos magnéticos que podem se repelir ou se atrair. Essa rotação é chamada de spin, que em inglês significa “girar”. Se tivermos dois elétrons girando em sentidos contrários (spins opostos), teremos uma atração entre eles. Mas, se estiverem girando para o mesmo lado (spins iguais), eles irão se repelir.
Devido a isso, se dois elétrons estiverem num mesmo orbital, eles devem ter spins opostos. Cada spin é representado por uma seta e por um valor:
ms = +1/2 ou -1/2
ms = ↑ ou ↓
Nesse caso, convencionamos que a seta para cima representa o valor +1/2 e que a seta para baixo representa o valor -1/2, mas poderia ser ao contrário também.
É importante ressaltar que em cada orbital representado por um quadrado cabem no máximo dois elétrons que devem apresentar spins opostos.
Agora, vejamos um exemplo para ver como determinar os quatro números quânticos de um determinado elétron:
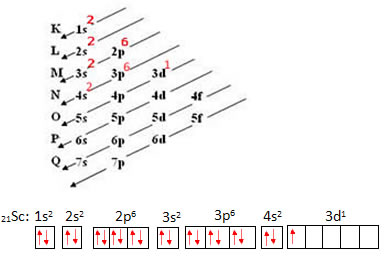
Consideremos o átomo de Escândio, que possui 21 elétrons. Vejamos qual será o conjunto de números quânticos que irá representar o seu elétron mais energético:
- Primeiro realizamos a sua distribuição eletrônica e depois a distribuição eletrônica nos orbitais:
A representação simbólica do elétron mais energético é:
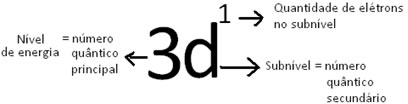
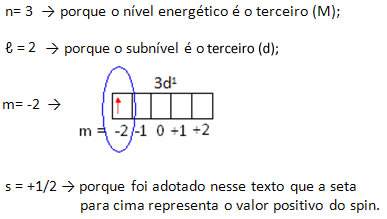
Assim, temos que os números quânticos do elétron mais energético do escândio são:
Aproveite para conferir nossa videoaula sobre o assunto:


