A Química Inorgânica é um ramo da Química que se dedica ao estudo, análise e experimentação de compostos inorgânicos, ou seja, substâncias que, em sua maioria, não contêm ligações carbono-hidrogênio, diferenciando-se assim da Química Orgânica. Nesse sentido, essa área abrange uma ampla variedade de substâncias, que vão desde simples íons até complexos minerais e metais, passando por ácidos, bases, sais e óxidos.
Para se ter uma ideia, quando adicionamos sal de cozinha (cloreto de sódio) à água para cozinhar, estamos aplicando princípios da Química Inorgânica relacionados à solubilidade e à alteração do ponto de ebulição da água. Da mesma forma, os metais que utilizamos em nossos dispositivos eletrônicos, como o cobre nos fios elétricos ou o lítio em baterias de smartphones, são estudados dentro dessa área, revelando a importância da Química Inorgânica na inovação tecnológica e na sustentabilidade.
Leia também: Química Geral — detalhes sobre um dos ramos mais estudados da Química
Tópicos deste artigo
- 1 - Resumo sobre Química Inorgânica
- 2 - O que é a Química Inorgânica?
- 3 - O que se estuda na Química Inorgânica?
- 4 - Para que serve a Química Inorgânica?
- 5 - Química Inorgânica x Química Orgânica
- 6 - Qual a importância da Química Inorgânica?
- 7 - História da Química Inorgânica
- 8 - Exercícios resolvidos sobre Química Inorgânica
Resumo sobre Química Inorgânica
-
A Química Inorgânica é um ramo da Química que aborda propriedades, reações e aplicações de substâncias inorgânicas.
-
Estuda a tabela periódica, as ligações químicas, estequiometria, gases nobres, compostos de coordenação, funções inorgânicas, reações inorgânicas e a química dos metais.
-
Inclui elementos metálicos, ácidos, bases, sais, óxidos e ligas metálicas.
-
Explora as ligações químicas, como iônicas, covalentes e metálicas.
-
Investiga as reações inorgânicas, como síntese, decomposição, substituição e dupla troca.
-
Tem aplicações em diversas áreas, como indústria, medicina, energia e meio ambiente.
-
Atua no desenvolvimento de novos materiais, como cerâmicas e ligas metálicas.
-
Possui contribuições na compreensão da Geologia e Geoquímica.
-
Apresenta fundamentos essenciais para o ensino e pesquisa em Química.
-
Teve início com os alquimistas, mas somente nos últimos séculos desenvolveu-se como ciência.
O que é a Química Inorgânica?
A Química Inorgânica é o ramo da Química que estuda os compostos que não contêm exclusivamente carbono-hidrogênio, chamados de compostos inorgânicos. Sendo assim, ela se concentra principalmente nos elementos químicos e em como eles se combinam para formar compostos, incluindo minerais, metais, ácidos, bases e sais.
O que se estuda na Química Inorgânica?
Na Química Inorgânica, além dos aspectos introdutórios, como uma breve revisão dos conceitos básicos da Química, como átomos, elementos e compostos, também é estudada uma gama de temas, como a estrutura dos compostos inorgânicos, suas propriedades, reatividades e aplicações práticas. Diante disso, quanto à divisão didática, veja a seguir alguns dos principais tópicos abordados dentro dessa disciplina:
-
Tabela periódica: estudo da organização dos elementos, incluindo grupos, períodos, propriedades periódicas e tendências.
-
Ligações químicas: explicação sobre as ligações iônica, covalente e metálica.
-
Estequiometria: cálculos envolvendo reações químicas, incluindo cálculo de massa, volume e quantidade de substâncias.
-
Gases nobres: estudo das propriedades e características dos gases nobres, com destaque para o hélio, neônio, argônio, criptônio e xenônio.
-
Compostos de coordenação: introdução aos compostos de coordenação, incluindo ligantes, íons complexos e nomenclatura.
A seguir, veja detalhes sobre alguns dos principais aspectos estudados na Química Inorgânica.
→ Funções inorgânicas
As funções inorgânicas são grupos de substâncias que têm propriedades químicas semelhantes. Nesse contexto, as principais funções estudadas são ácidos, bases, sais e óxidos. Vamos falar brevemente sobre cada uma delas no quadro abaixo:
|
Função inorgânica |
Definição |
Exemplo |
|
Ácidos |
Substâncias que, em solução aquosa, liberam íons de hidrogênio (H+). Eles têm sabor azedo, são corrosivos e podem reagir com metais para liberar hidrogênio gasoso. |
Ácido clorídrico: HCl |
|
Bases |
Substâncias que, em solução aquosa, liberam íons de hidroxila (OH-). Elas têm sabor amargo, são cáusticas e podem neutralizar ácidos. |
Hidróxido de sódio: NaOH (soda cáustica) |
|
Sais |
Compostos formados pela reação entre um ácido e uma base, em que a água e um sal são os produtos. Eles são compostos iônicos e podem ser formados por diferentes combinações de ácidos e bases. |
Cloreto de sódio: NaCl (sal de cozinha) |
|
Óxidos |
Compostos formados pela combinação de oxigênio com outro elemento. Eles podem ser ácidos, básicos ou neutros, dependendo da natureza do outro elemento. |
Óxido de cálcio: CaO (cal virgem) |
Para saber mais sobre as funções inorgânicas, clique aqui.
→ Reações inorgânicas
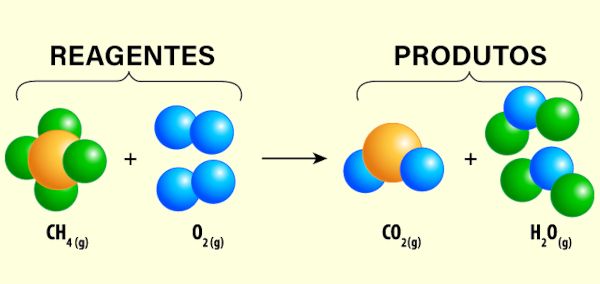
Em reações inorgânicas, como você deve imaginar, estudamos as transformações que ocorrem entre substâncias inorgânicas. Nesse contexto, devemos lembrar a inexistência de ligações covalentes entre os pares ligantes, sendo, então, uma reação de natureza iônica ou metálica. Dessa forma, podemos classificá-las como reações de síntese (ou adição), análise (ou decomposição), substituição, dupla troca e neutralização, sendo esta última uma espécie de dupla troca. Diante disso, a seguir, veja o quadro exemplificativo sobre cada uma delas.
|
Tipo de reação |
Descrição |
Exemplo |
|
Síntese ou adição |
Duas ou mais substâncias se combinam para formar um único produto. |
Síntese do cloreto de sódio (NaCl) a partir de sódio metálico (Na) e cloro gasoso (Cl2). |
|
Análise ou decomposição |
Uma substância se decompõe em duas ou mais substâncias diferentes. |
Decomposição do carbonato de cálcio (CaCO3) em óxido de cálcio (CaO) e dióxido de carbono (CO2). |
|
Substituição ou simples troca |
Um elemento em uma substância é substituído por outro elemento. |
Reação do zinco (Zn) com ácido clorídrico (HCl) para formar cloreto de zinco (ZnCl2) e hidrogênio (H2). |
|
Dupla troca |
Os cátions e ânions de duas substâncias diferentes trocam de lugar, formando dois produtos diferentes. |
Reação entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO3) para formar nitrato de sódio (NaNO3) e cloreto de prata (AgCl). |
|
Neutralização |
Uma reação entre um ácido e uma base que resulta na formação de água e um sal. |
Neutralização do ácido clorídrico (HCl) com hidróxido de sódio (NaOH) para formar cloreto de sódio (NaCl) e água (H2O). |
→ Química dos metais
Os metais são elementos que apresentam características distintas, como condutividade elétrica, brilho metálico, maleabilidade e ductilidade. Nesse sentido, a química dos metais estuda como esses elementos interagem entre si e com outras substâncias, formando ligas e compostos metálicos. Sendo assim, para fins de compreensão, organizamos, também, um quadro exemplificativo sobre os principais tópicos estudos nesse tema:
|
Tópico |
O que é estudado |
|
Propriedades dos metais |
As propriedades físicas (condutividade elétrica, condutividade térmica, brilho metálico, maleabilidade, ductilidade, ponto de fusão, densidade) e químicas dos metais. |
|
Formação de compostos metálicos |
Como os metais reagem com outros elementos para formar compostos, como óxidos, sulfetos, hidretos, etc. |
|
Ligas metálicas |
A formação e as propriedades das ligas, que são misturas sólidas de dois ou mais metais, com propriedades diferentes dos metais puros. |
|
Reatividade dos metais |
Compreende como os metais reagem com ácidos, bases, água e outros compostos, influenciando seu uso em diversas aplicações. |
|
Extração e produção de metais |
Os métodos de extração de metais de seus minérios e os processos de produção de metais puros a partir de compostos metálicos. |
|
Aplicações dos metais |
As diversas aplicações dos metais na indústria, como na fabricação de materiais de construção, utensílios domésticos, equipamentos eletrônicos, entre outros. |
Para saber mais sobre a química dos metais, clique aqui.
Para que serve a Química Inorgânica?
A Química Inorgânica tem a sua importância validada em quase todas as necessidades humanas, portanto diversas são as aplicações dessa área da ciência. Sendo assim, neste tópico separamos alguns dos seus principais usos:
-
Ajuda a compreender a natureza dos elementos químicos e como eles se combinam para formar diferentes compostos.
-
Muitos materiais importantes são estudados e desenvolvidos na Química Inorgânica, como semicondutores, cerâmicas, vidros especiais, catalisadores e ligas metálicas.
-
É crucial para o desenvolvimento de medicamentos e compostos farmacêuticos, incluindo agentes de contraste em exames médicos.
-
É essencial para a produção de produtos químicos utilizados em diversas indústrias, como fertilizantes, detergentes e pigmentos.
-
Ajuda a compreender e tratar questões ambientais, como poluição do ar, água e solo, além de contribuir para o desenvolvimento de tecnologias ambientalmente amigáveis.
-
Contribui para o desenvolvimento de tecnologias de energia, como células de combustível, baterias e processos de armazenamento de energia.
-
Auxilia na compreensão dos processos geológicos e na identificação de minerais e elementos em rochas e solos.
-
É fundamental para o ensino e pesquisa em Química, fornecendo a base para o estudo de áreas mais especializadas da Química.
Química Inorgânica x Química Orgânica
Diferentemente da Química Orgânica, que se concentra principalmente em compostos de carbono, a Química Inorgânica explora as propriedades únicas dos elementos químicos e suas interações, contribuindo para uma compreensão mais profunda da natureza e dos materiais inorgânicos que nos rodeiam. Em vista disso, veja a seguir a principais características dessas grandes áreas da Química e como elas se diferenciam.
|
Características |
Química Inorgânica |
Química Orgânica |
|
Composição |
Estuda os elementos e compostos inorgânicos, que não contêm exclusivamente carbono-hidrogênio. |
Estuda os compostos orgânicos, que contêm carbono-hidrogênio. |
|
Elementos |
Envolve todos os elementos da tabela periódica. |
Concentra-se principalmente nos elementos do grupo do carbono. |
|
Ligações químicas |
Aborda ligações iônicas, covalentes e metálicas. |
Enfoca principalmente ligações covalentes. |
|
Propriedades |
Estuda propriedades de metais, ácidos, bases, sais, óxidos, etc. |
Estuda propriedades de hidrocarbonetos, álcoois, ácidos carboxílicos, etc. |
|
Reações |
Inclui reações de síntese, decomposição, simples troca, dupla troca e neutralização. |
Inclui reações de substituição, adição, eliminação, oxidação, redução, etc. |
|
Aplicações |
Tem aplicações em indústria, medicina, energia e meio ambiente. |
Tem aplicações em síntese de produtos naturais, farmacêutica, polímeros, etc. |
|
Exemplos |
Cloreto de sódio (NaCl), ácido clorídrico (HCl), óxido de ferro (Fe2O3). |
Metano (CH4), etanol (C2H5OH), ácido acético (CH3COOH). |
Para saber mais sobre a Química Orgânica, clique aqui.
Qual a importância da Química Inorgânica?
A Química Inorgânica é importante principalmente pela compreensão dos elementos químicos e de como eles se combinam para formar compostos, uma vez que isso é essencial para muitas áreas da ciência, incluindo a Física, a Biologia e a Geologia.
Ademais, essa área é crucial para o desenvolvimento de novos materiais, como cerâmicas, ligas metálicas e materiais de construção, que são utilizados em diversas indústrias e contribuem para o avanço da tecnologia.
Nesse contexto, também vale destacar que ela desempenha um papel importante no setor farmacêutico, bem como na produção de produtos químicos, como fertilizantes, detergentes e pigmentos. Diante disso, nem precisamos falar o quanto esses produtos são essenciais para a nossa vida cotidiana e para o funcionamento de muitos setores da economia, não é?
História da Química Inorgânica
Embora seja uma ciência antiga, o desenvolvimento da Química Inorgânica como uma disciplina científica distinta ocorreu principalmente nos últimos séculos. Em vista disso, vejamos a seguir um breve resumo desse progresso:
-
Antiguidade: os alquimistas foram os primeiros a explorar os processos químicos e a busca pela transmutação de metais em ouro e pela obtenção do elixir da longa vida. Embora muitas das práticas alquímicas fossem baseadas em especulações e crenças místicas, elas contribuíram para o desenvolvimento de técnicas e métodos de laboratório que seriam fundamentais para a Química moderna.
-
Século XVII: com o avanço da ciência e a adoção do método científico, os cientistas começaram a investigar mais profundamente as propriedades dos elementos e dos compostos inorgânicos. Nesse contexto, Robert Boyle, considerado um dos fundadores da Química moderna, fez importantes contribuições para o entendimento dos gases e da relação entre pressão e volume.
-
Século XVIII: Antoine Lavoisier realizou experimentos cruciais que levaram à reformulação da teoria química, incluindo a rejeição da teoria do flogisto e a introdução do conceito de elementos químicos. Além disso, ele também desenvolveu a nomenclatura química moderna e é conhecido como o pai da Química moderna.
-
Século XIX: a Química Inorgânica continuou a se desenvolver rapidamente, com a descoberta de muitos novos elementos e o estabelecimento de princípios fundamentais, como a lei periódica de Mendeleev, que organizava os elementos de acordo com suas propriedades químicas.
-
Século XX: ela se expandiu ainda mais, com o desenvolvimento de novos materiais, catalisadores e compostos de coordenação. Hoje, ela continua a ser uma área em constante evolução em pesquisas, com aplicações em diversas áreas, como materiais, medicina, energia e meio ambiente.
Exercícios resolvidos sobre Química Inorgânica
Questão 1
(Uerj) O composto de fórmula FeCl3 é empregado no tratamento de águas por conta de sua ação coagulante sobre impurezas. Esse composto pertence à seguinte função inorgânica:
A) sal
B) base
C) ácido
D) óxido
Resolução:
Alternativa A.
Primeiro, vale ressaltar que todas as funções apresentadas como opções são inorgânicas. Diante disso, devemos analisar o composto dado na questão: FeCl3, e enquadrá-lo em uma dessas opções. Por eliminação, o composto não apresenta oxigênio, logo não é um óxido. Da mesma forma, não apresenta nem hidroxila (OH-), para ser considerado uma base, nem hidrogênio (H+), como os ácidos. Portanto, só resta como opção ser um sal.
Questão 2
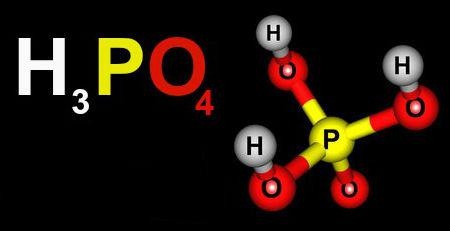
(Unifoa) Das alternativas abaixo, assinale a que contém somente sais:
A) NaCl, KOH, KCl e H2CO3
B) HCl, NaOH, Na2CO3 e H3PO4
C) HClO3, NaCl, Ca(OH)2 e H3PO4
D) Be(OH)2, Al(OH)3, H3PO4 e H2SO4
E) Na2CO3, NaCl, LiCl e (NH4)2CO3
Resolução:
Alternativa E.
Os sais são constituídos de cátions e ânions provenientes de ácidos e bases, respectivamente, das reações de neutralização. Posto isso, com exceção dos sais ácidos e dos sais básicos, o produto desse tipo de reação não irá apresentar nem H+, nem OH-. Portanto, dentre as opções apresentadas no caso em comento, devemos selecionar aquela em que os compostos formados contêm apenas cátions e ânions diferentes de H+ e OH-. Sendo assim, como alternativa temos a letra “e”.
Fontes
FELTRE, R. Ácidos, bases e sais inorgânicos. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1p. 188–201.
PERUZZO, F. M.; CANTO, E. L. DO. Algumas reações inorgânicas de importância. In: Química geral e inorgânica. 4. ed. São Paulo: Moderna, 2006. p. 408.
REIS, M. Compostos inorgânicos. In: Química 1 - Ensino Médio. 1a ed. São Paulo: Editora Ática, 2013. v. 1p. 283–284.
WELLER, M. et al. Ácidos e bases. In: Química Inorgânica. 6. ed. Porto Alegre: Bookman, 2017. p. 116–150.