As ligações químicas são a base para compreensão dos processos de formação das substâncias. Elas atuam como resultado de uma força de atração entre átomos que, de certa forma, buscam uma estabilização dos seus elétrons de valência, isto é, um estado de menor energia, no qual uma reação espontânea já não será mais possível. Nesse sentido, sem elas os átomos estariam isolados, incapazes de formar as substâncias que compõem o mundo. Por isso, desde a água que bebemos até os materiais que usamos no dia a dia, tudo depende dessas interações entre átomos.
Por exemplo, quando ingerimos alimentos, o processo de digestão trabalha na quebra de ligações químicas para que os nutrientes sejam absorvidos da forma devida pelo nosso organismo. Consequentemente outras ligações químicas são formadas durante esse processo, e, assim, segue o nosso organismo em um meio reacional interminável no qual ligações químicas são simultaneamente rompidas e criadas. Portanto, compreender como essas ligações funcionam é essencial para entender as propriedades dos materiais e os processos que ocorrem em nosso corpo e no ambiente.
Leia também: Como ocorrem as reações químicas
Tópicos deste artigo
- 1 - Resumo sobre ligações químicas
- 2 - Videoaula sobre ligações químicas
- 3 - O que são ligações químicas?
- 4 - Tipos de ligações químicas
- 5 - Como identificar os tipos de ligações químicas?
- 6 - Ligações químicas e a regra do octeto
- 7 - Qual é a importância das ligações químicas?
- 8 - Exercícios resolvidos sobre ligações químicas
Resumo sobre ligações químicas
- As ligações químicas são forças que unem átomos para formar moléculas ou compostos.
- Existem três tipos principais de ligações: iônica, covalente e metálica.
- Ligação iônica ocorre quando há transferência de elétrons entre um metal e um ametal.
- Ligação covalente envolve o compartilhamento de elétrons entre dois ametais.
- Ligação metálica ocorre entre átomos de metais, com elétrons livres circulando.
- A regra do octeto explica que os átomos formam ligações para alcançarem 8 elétrons na camada de valência, obtendo estabilidade.
- As ligações químicas influenciam as propriedades das substâncias, como ponto de fusão, solubilidade e condutividade.
- São essenciais para a formação de todas as substâncias no Universo.
Videoaula sobre ligações químicas
O que são ligações químicas?
Ligações químicas são forças que mantêm os átomos unidos em moléculas ou compostos. Elas ocorrem quando os átomos compartilham ou transferem elétrons entre si, com o objetivo de alcançar uma configuração eletrônica mais estável, geralmente semelhante à de um gás nobre.
Tipos de ligações químicas
Existem três tipos principais de ligações:
- a ligação iônica, em que há transferência de elétrons entre átomos;
- a ligação covalente, na qual os átomos compartilham elétrons; e
- a ligação metálica, que ocorre entre átomos de metais, com elétrons livres circulando.
Essas interações determinam as propriedades físicas e químicas das substâncias.
Veja também: O que difere ao ametais dos metais?
Como identificar os tipos de ligações químicas?
Para identificar os tipos de ligações químicas, é necessário observar as características dos átomos envolvidos e suas interações, por exemplo:
→ Ligação iônica
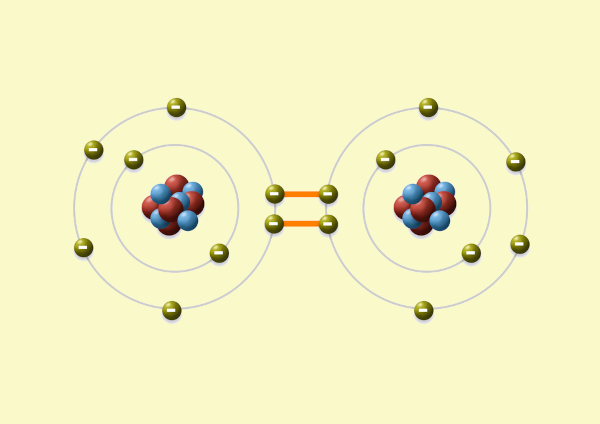
Ocorre entre um metal e um ametal, com o metal doando elétrons para o ametal, formando íons (cátions e ânions), que se atraem por forças eletrostáticas. Contudo, para fazer essa identificação, é importante saber quem são os metais e os ametais. Nesse caso, os elementos representativos (grupo 1, grupo 2 e grupos 14-17) são os mais comuns nesse tipo de ligação.
Como exemplo clássico temos cloreto de sódio (NaCl), em que o Na é um metal e o Cl é um ametal, e juntos formam um composto iônico por meio da doação de um elétron do átomo de Na ao átomo de Cl, conforme é ilustrado abaixo.
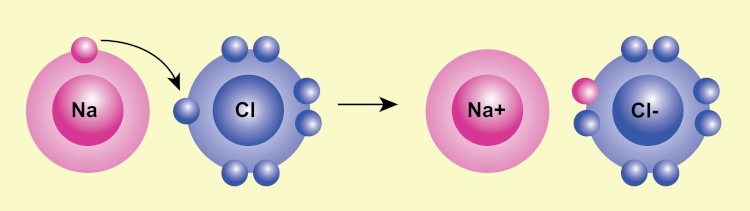
→ Ligação covalente
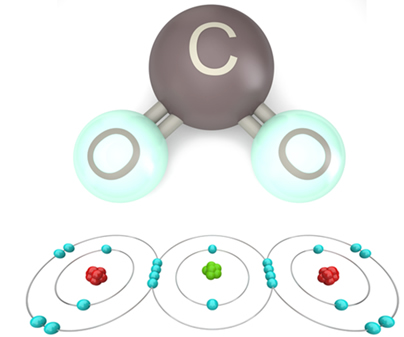
Acontece entre dois ametais ou entre um ametal e hidrogênio, com os átomos compartilhando elétrons para alcançar estabilidade. No exemplo abaixo, temos a representação de uma dupla ligação covalente entre dois átomos de oxigênio (ametal) para formar a molécula de oxigênio (O2).
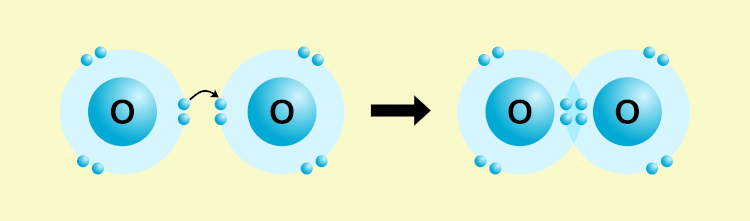
Já no exemplo a seguir temos a formação da molécula de água (H2O) pelas ligações covalentes entre hidrogênio (H) e oxigênio (O).
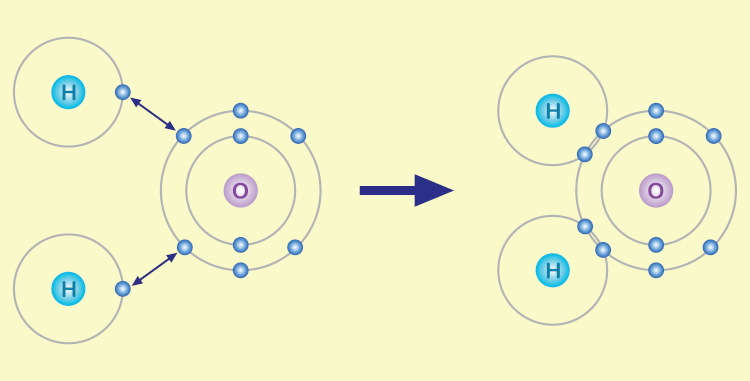
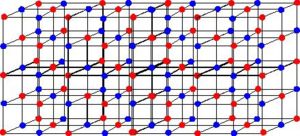
→ Ligação metálica
Esse tipo de ligação está presente entre átomos de metais, com os elétrons ficando livres para se moverem, formando um “mar de elétrons”, que mantém os átomos unidos. Uma das melhores formas de visualizar esse modelo está na imagem abaixo.
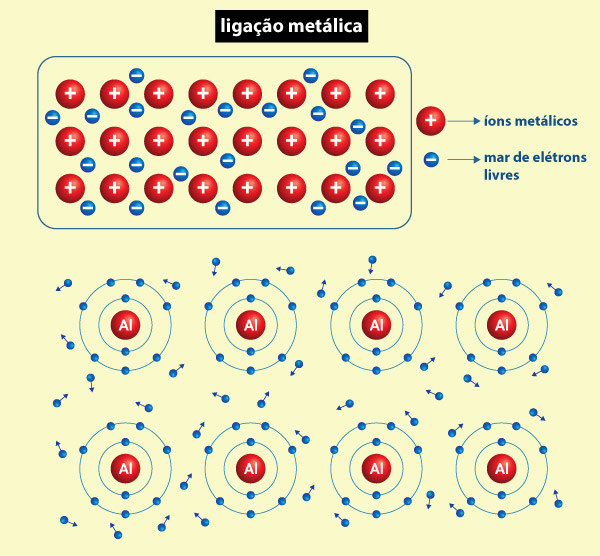
Um fato interessante sobre as ligações químicas é que a diferença de eletronegatividade entre os átomos ajuda a prever o tipo de ligação, de modo que, em um valor menor que 0,4, os átomos compartilham os elétrons de maneira quase igual, formando uma ligação covalente apolar. Contudo, se essa diferença de eletronegatividade variar entre 0,4 e 1,7, há um compartilhamento desigual dos elétrons, formando uma ligação covalente polar. Por fim, caso o valor seja maior que 1,7, ocorre a transferência de elétrons de um átomo para o outro, formando íons e, portanto, uma ligação iônica.
Ligações químicas e a regra do octeto
A regra do octeto está diretamente relacionada às ligações químicas porque explica como os átomos se ligam entre si. De acordo com essa regra, os átomos tendem a alcançar 8 elétrons na sua camada de valência (camada mais externa), o que lhes dá uma estabilidade semelhante à dos gases nobres. Dessa forma, para atingir essa configuração, eles formam ligações citadas ao longo desse artigo (covalentes, iônicas e metálicas).
Uma forma de ilustrar isso é pelo exemplo da ligação covalente na molécula de oxigênio, como pode ser visto a seguir. Ambos os átomos de O passam a ter 8 elétrons de forma simultânea em suas camadas de valência:
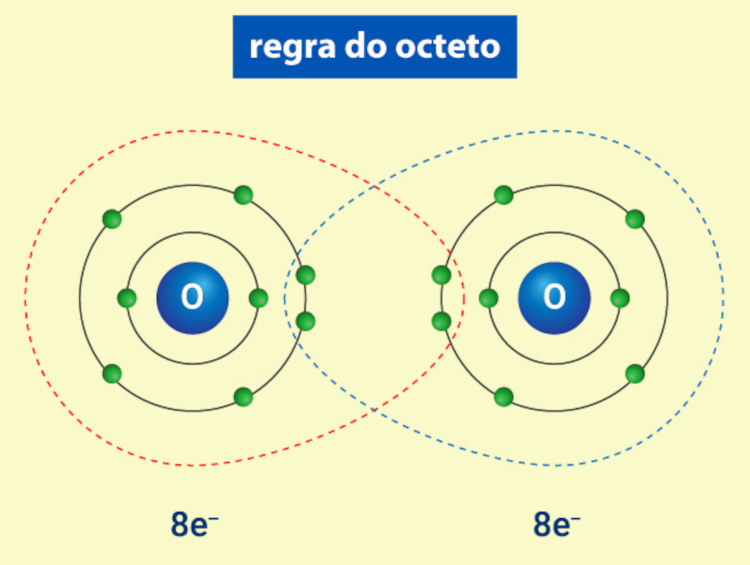
Assim, a regra do octeto é o que dá embasamento para formação das ligações químicas. Saiba mais sobre a regra do octeto clicando aqui.
Qual é a importância das ligações químicas?
Diante de tudo que foi falado até aqui, não restam dúvidas de que as ligações químicas são fundamentais para existência do Universo, porquanto possibilitam a formação de todas as substâncias ao nosso redor, que vão desde o ar que respiramos até toda a estrutura do corpo humano. Dessa forma, sem a atuação dessas forças, os átomos não conseguiriam se unir para formar moléculas, compostos ou materiais sólidos.
Além disso, elas determinam as propriedades físicas e químicas das substâncias, como dureza, ponto de fusão, solubilidade e condutividade elétrica. Por exemplo, a água é líquida e o sal é sólido por causa dos tipos de ligações entre seus átomos. Portanto, estudar essas ligações é essencial para compreender como a matéria se comporta e como as reações químicas acontecem.
Saiba mais: Como saber se uma ligação química é polar ou apolar?
Exercícios resolvidos sobre ligações químicas
1) (PUC-RS) Considere as propriedades físico-químicas dos compostos X, Y e Z apresentadas no quadro a seguir.
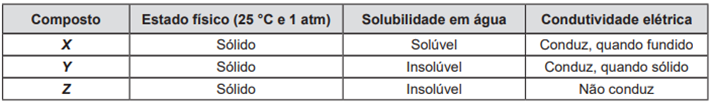
Com base no quadro, a natureza da ligação química mais provável para os compostos X, Y e Z é, respectivamente, _________, _________ e _________.
a) ligação covalente – ligação iônica – ligação iônica.
b) ligação metálica – ligação covalente – ligação iônica.
c) ligação iônica – ligação metálica – ligação covalente.
d) ligação covalente – ligação iônica – ligação metálica.
Gabarito: c)
Uma vez que os três compostos estão no estado sólido, devemos analisar a solubilidade e condutividade. Sendo assim, de acordo com o quadro, o composto X é solúvel e conduz eletricidade quando fundido, característica marcante dos compostos iônicos. Logo, temos nossa resposta, já que alternativa c) é a única que inicia com ligação iônica. Contudo, vejamos as demais opções: o composto Y é um metal, pois é insolúvel em água e conduz eletricidade quando sólido, logo, sua ligação é metálica. Já o composto Z só pode ser um composto com ligações covalentes, já que, além da insolubilidade em água, também não conduz eletricidade.
2) (UEMG) - Quando ocorre transferência de elétrons entre dois átomos, há formação de um cátion e um ânion. Esses íons se atraem fortemente, dando origem aos compostos iônicos.
Entre as fórmulas apresentadas a seguir, aquela que representa uma substância formada por atração de íons é
a) H2O2.
b) MgCl2.
c) N2O3.
d) SO3.
Gabarito: b)
Nesse caso, a questão deixa explícito que a opção correta é aquela que tem um composto iônico, ou seja, que é formado por ligações iônicas. Sendo assim, ao analisar cada composto, podemos constatar que o H2O2 é formado por hidrogênio e um ametal (oxigênio), logo, a ligação é covalente. O MgCl2 contém um metal (Mg) e um ametal (Cl), formando, portanto, uma típica ligação iônica (nosso gabarito). De toda forma e para fins de constatação, vejamos as demais: No N2O3 e no SO3, tanto o nitrogênio (N) quanto o enxofre (S) são ametais, assim como o oxigênio (O), logo, também formam ligações covalentes, isto é, são compostos moleculares.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. As moléculas. In: Princípios de Química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 67–135.
FELTRE, R. As ligações químicas. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1p. 136–155.
L. BROWN, T. et al. Conceitos básicos da ligação química. In: Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 316–341.