Conforme explicado no texto “Ligação Covalente, Molecular ou Homopolar”, a ligação covalente se dá entre elementos eletronegativos, que têm a tendência de ganhar elétrons, por meio do compartilhamento de pares eletrônicos. Desse modo, os elementos envolvidos ficam estáveis, pois completam seu octeto eletrônico, ou seja, ficam com oito elétrons na camada de valência e adquirem configuração de gás nobre.
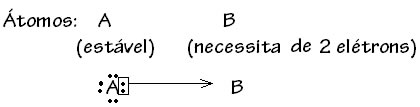
No entanto, existem alguns casos em que um dos átomos envolvidos já adquiriu estabilidade enquanto que outro átomo participante da ligação ainda necessita de dois elétrons para completar sua camada de valência. Desse modo, o átomo, já estável, compartilha um par de elétrons com o outro átomo ainda instável.
Nesse caso, é uma ligação covalente, por haver compartilhamento de elétrons e por não haver formação de íons, pois não há transferência definitiva desses elétrons. Porém, não se trata de uma ligação covalente comum, porque a ligação não ocorre com um elétron proveniente de cada átomo, mas sim com os elétrons de um único átomo que já estava estável.
Esse caso particular da ligação covalente é denominado Ligação Covalente Dativa ou Coordenada.
De modo genérico, a ligação covalente dativa é esquematizada por:
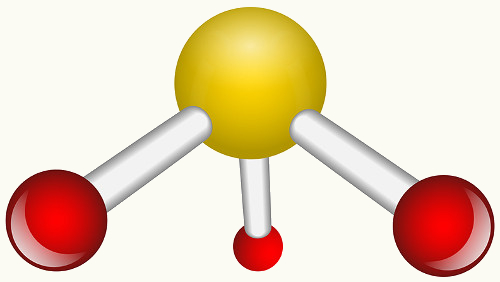
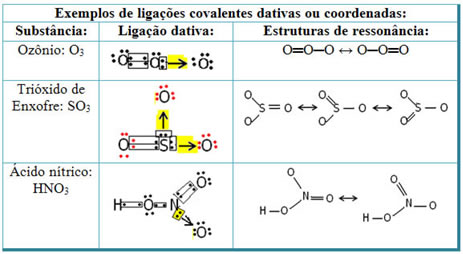
Veja abaixo os exemplos do dióxido de enxofre (SO2):
![]()
Observe que o enxofre (S) já estava estável (com oito elétrons em sua camada de valência), pois já havia compartilhado um par de elétrons com um átomo do elemento oxigênio. Porém, o outro átomo de oxigênio ainda estava instável, precisando receber dois elétrons. Assim, o enxofre realizou uma ligação covalente dativa com esse oxigênio, compartilhando dois de seus elétrons com ele, para que ficasse estável.
Note que foi usada uma seta para representar a ligação covalente dativa e diferenciá-la da ligação covalente comum. No entanto, só a usamos nesse exemplo para fins didáticos, ou seja, para melhorar a visualização e o entendimento. Porém, nesses casos, o aconselhado é usar as estruturas de ressonância.
Para se entender o que é ressonância, note que no exemplo citado (O?S?O), pode haver uma “migração” das ligações de um átomo de oxigênio para o outro, desse modo há duas estruturas possíveis para essa substância: O?S?O e O?S?O.
Essas duas representações são estruturas de ressonância, outros exemplos disso estão demonstrados abaixo:
Relacionando as ligações covalentes dativas com os elementos da Tabela Periódica, temos que, assim como ocorre na ligação covalente comum, os elementos que participam dela devem ser ametais ou semimetais e que as possíveis ligações covalentes dativas dos elementos das famílias participantes são:
.jpg)
Aproveite para conferir nossa videoaula relacionada ao assunto: