Os óxidos anfóteros, como qualquer óxido, são compostos binários que apresentam o oxigênio como elemento mais eletronegativo. Eles são formados por metais ou semimetais, principalmente dos grupos 13, 14 e 15 da Tabela Periódica. Esses elementos apresentam média eletronegatividade e eletropositividade.
Esses óxidos podem comportar-se como óxidos básicos ou ácidos quando participam de reações químicas na presença de ácidos ou bases, respectivamente.
Elementos constituintes e fórmulas químicas
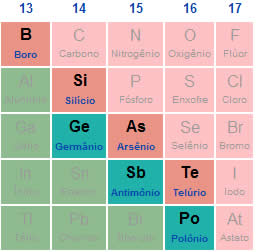
Geralmente, um óxido anfótero apresenta estas fórmulas químicas: YO, YO2 ou Y2O3. O elemento Y é um dos propostos abaixo:
-
Chumbo (Pb): pode apresentar NOX +2 e +4, sendo os dois formadores de óxidos anfóteros: PbO e PbO2;
-
Berílio (Be): como o berílio apresenta apenas o NOX +2, a fórmula do seu óxido anfótero é BeO;
-
Alumínio (Al): como o alumínio apresenta apenas o NOX +3, a fórmula do seu óxido anfótero é Al2O3;
-
Estanho (Sn): o estanho é um elemento que pode apresentar NOX +2 e +4, sendo os dois formadores de óxidos anfóteros: SnO e SnO2;
-
Silício (Si): como o silício apresenta apenas o NOX +4, a fórmula do seu óxido anfótero é SiO2;
-
Zinco (Zn): como o zinco apresenta apenas o NOX +2, a fórmula do seu óxido anfótero é ZnO;
-
Antimônio (Sb): pode apresentar NOX +3 e +5, mas apenas o de NOX +3 forma óxido anfótero, cuja fórmula é Sb2O3;
-
Arsênio (As): pode apresentar NOX +3 e +5, mas apenas o de NOX +3 forma óxido anfótero, cuja fórmula é As2O3;
-
Crômio (Cr): apresenta vários NOX possíveis, mas o único que forma óxido anfótero é o crômio de NOX +3, cuja fórmula do óxido é Cr2O3.
Características químicas
Os óxidos anfóteros são assim chamados por causa de seu comportamento químico ambíguo. Isso porque, quando em presença de um ácido inorgânico, eles funcionam como um óxido básico e, na presença de uma base inorgânica, funcionam como um óxido ácido.
Seja na presença de um ácido, seja na presença de uma base inorgânica, o óxido anfótero sempre neutraliza a outra substância presente no reagente, formando um sal inorgânico e água.
a) Reação de óxido anfótero com ácido inorgânico
Quando um óxido anfótero reage com um ácido inorgânico (HX), o metal ou semimetal presente no óxido interage com o ânion (X-), formando um sal, e o hidrogênio ionizável do ácido interage com átomos de oxigênio do óxido, formando a molécula de água.
YO + HX →YX + H2O
Exemplo: Reação entre óxido de crômio III (Cr2O3) e ácido fosfórico (H3PO4)
Cr2O3 + 2 H3PO4→ 2 CrPO4 + 3H2O
Na equação, o metal crômio (Cr) do óxido interagiu com o ânion fosfato (PO4-3) do ácido para formar o sal. Já os hidrogênios ionizáveis do ácido interagiram com os oxigênios do óxido, formando moléculas de água.
b) Reação de óxido anfótero com base inorgânica
Quando um óxido anfótero reage com uma base, o metal da base interage com o ânion formado a partir de componentes do óxido. A água é formada a partir do oxigênio do óxido e do hidrogênio da hidroxila da base.
YO + ZOH →ZYO + H2O
Os ânions formados pelos metais e semimetais presentes nos óxidos anfóteros, quando eles estão reagindo com uma base inorgânica, são:
-
Alumínio: forma o aluminato (AlO2-1)
-
Zinco: forma o zincato (ZnO2-2)
-
Chumbo: plumbito (PbO2-2) ou plumbato (PbO3-2)
-
Estanho: estanito (PbO2-2) ou estanato (PbO3-2)
-
Berílio: berilato (AlO2-2)
-
Crômio: cromito (CrO2-1)
-
Antimônio: antimonito (SbO3-3)
-
Arsênio: arsenito (AsO3-3)
Exemplo: Reação entre óxido de zinco (ZnO) e hidróxido de cálcio [Ca(OH)2]
ZnO + Ca(OH)2 → 2 CaZnO2 + H2O
Temos na equação um óxido que possui o metal zinco, assim, o cálcio interage com o ânion zincato (ZnO2-2), e o hidrogênio da hidroxila interage com o oxigênio do óxido para formar a água.