A nomenclatura dos óxidos deve levar em consideração o tipo de óxido: iônico ou molecular. Assim, temos diferentes regras para esses dois casos. Observe cada uma:
| *Óxidos iônicos: |
Esses compostos são formados normalmente entre o oxigênio e os metais. O oxigênio possui carga 2- e, com cada metal, é possível formar apenas um óxido. Uma exceção é o ferro, que é metal, mas forma dois óxidos diferentes, conforme será visto mais adiante.
Um exemplo de óxido assim é o CaO, conhecido como cal virgem, que ao ser hidratado (Ca(OH)2) é usado para fazer pinturas de caiação.
Sua regra de nomenclatura é a seguinte:

Exemplos:
Na2O: óxido de sódio
CaO: óxido de cálcio
| *Óxidos moleculares: |
São formados geralmente com ametais e formam mais de um óxido. Em razão disso, é necessário indicar a quantidade de oxigênios e dos elementos ligados a ele, por meio de prefixos como mono, di, tri, etc.
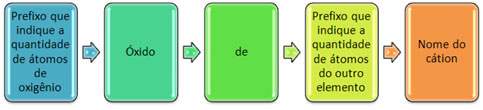
É possível também indicar a quantidade do outro elemento por meio de algarismos romanos. Veja os exemplos:
CO: monóxido de carbono
CO 2 : dióxido de carbono
NO: monóxido de nitrogênio
NO 2 : dióxido de nitrogênio
N 2 O: monóxido de dinitrogênio
N 2 O5: pentóxido de dinitrogênio
SiO2: dióxido de silício
Fe2O3: trióxido de diferro ou óxido de ferro III
FeO: monóxido de ferro ou óxido de ferro II
Aproveite para conferir nossas videoaulas relacionadas ao assunto: