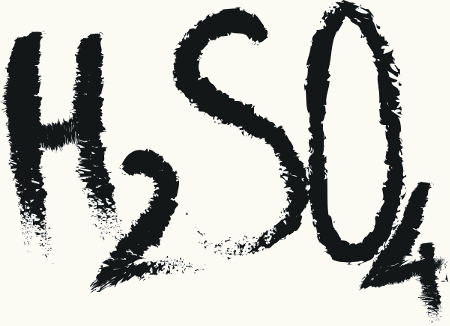Os nomes citados acima para os ácidos contidos no vinagre, no leite, na formiga e nas frutas cítricas, são nomes usuais (não oficiais), que foram dados pelas pessoas à medida que eles foram descobertos e têm muito a ver com a fonte de onde foram extraídos.
No entanto, para nomear os ácidos e todas as funções inorgânicas e orgânicas existentes, existem regras a serem seguidas mundialmente, estabelecidas pela IUPAC (União Internacional da Química Pura e Aplicada). A seguir enunciaremos as regras para os ácidos:
Primeiramente, é necessário saber que a regra de nomenclatura de hidrácidos (ácidos que não contêm oxigênio) é diferente da dos oxiácidos (contêm oxigênio). Assim, a explicação será dada primeiro para um grupo e posteriormente para o outro.
• Hidrácidos - Regra geral:

Exemplos:
HCl: ácido clorídrico
HF: ácido fluorídrico
HBr: ácido bromídrico
H2S: ácido sulfídrico
HCN: ácido cianídrico
• Oxiácidos - Quando forma apenas um oxiácido, segue a regra geral:

Se formar mais de um oxiácido com NOX. (números de oxidação) diferentes acrescenta-se os prefixos per ou hipo e os sufixos ico ou oso, segundo a tabela abaixo:

Em alguns casos, é possível nomeá-los de outra forma, seguindo a diminuição de átomos de oxigênio na molécula. Exemplos:
HClO4 (Nox do cloro = +7; 4 átomos de oxigênio): ácido perclórico
HClO3 (Nox do cloro = +5; 3 átomos de oxigênio): ácido clórico – ácido padrão
HClO2 (Nox do cloro = +3; 2 átomos de oxigênio): ácido cloroso
HClO (Nox do cloro = +1; 1 átomo de oxigênio): ácido hipocloroso
H2SO4 (Nox do enxofre = +6; 4 átomos de oxigênio): ácido sulfúrico – ácido padrão
H2SO3 (Nox do enxofre = +4; 3 átomos de oxigênio): ácido sulfuroso
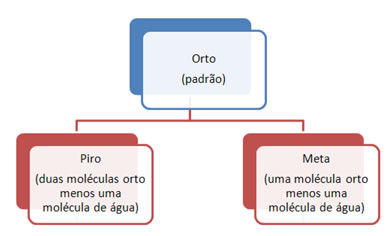
• Existem alguns casos em que o número de oxidação do elemento central não se altera. Para estes é usada outra nomenclatura em que se acrescentam os prefixos orto, piro e meta em relação ao grau de hidratação do ácido.
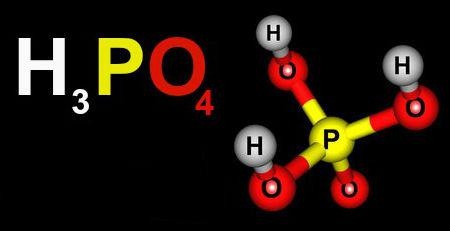
O prefixo orto é dispensável, pois ele indica o ácido padrão. Por exemplo, o ácido fosfórico H3PO4 é também chamado de ácido ortofosfórico.
Já o H4P2O7, possui duas moléculas do orto menos uma molécula de água:
H3PO4 + H3PO4= H6P2O8 → H6P2O8 - H2O = H4P2O7
Assim, este é chamado de ácido pirofosfórico.
Por último, o ácido HPO3 possui uma molécula do orto menos uma molécula de água, sendo o menos hidratado dos três. Ele é denominado ácido metafosfórico:
H3PO4 - H2O = HPO3
De modo que a regra geral é: