A força dos ácidos inorgânicos é medida de acordo com o grau de ionização (α) deles em solução aquosa. Esse grau de ionização (α) é medido experimentalmente e pode ser obtido pela relação entre a quantidade de moléculas que se ionizaram e a quantidade total de moléculas que foram dissolvidas:

Esse valor pode variar de 0 a 1 e também pode ser expresso em porcentagem, variando de 05 a 100%. Se o valor do grau de ionização for maior que 50%, o ácido é considerado um ácido forte, se for menor que 5%, será um ácido fraco; mas, se for maior que 5% e menor que 50%, é um ácido moderado, também chamado de ácido semiforte.

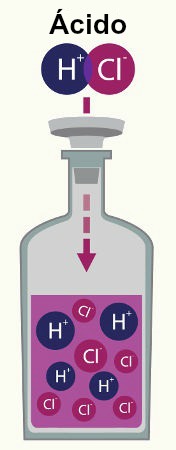
Por exemplo, se dissolvermos 1000 moléculas de ácido clorídrico (HCl) e 920 se ionizarem, isso quer dizer que o grau de ionização desse ácido é igual a 92%, como mostrado no cálculo abaixo. Portanto, ele é um ácido forte.
α = 920 = 0,92 . 100% = 92%
1000
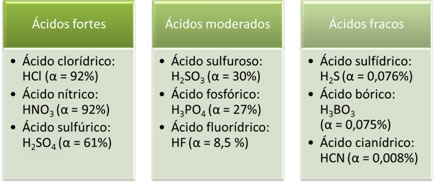
A seguir, temos exemplos de ácidos fortes, moderados e fracos:
Quanto maior for o grau de ionização, maior será a condutibilidade elétrica, pois o ácido possuirá mais íons dissolvidos na solução.
É importante ressaltar que a força de um ácido não é medida pelo número de hidrogênios ionizáveis, ou seja, aqueles hidrogênios do ácido que estiverem ligados a outro átomo ou grupo de átomos que forem mais eletronegativos que ele. No caso dos hidrácidos, todos os hidrogênios são ionizáveis, já no caso dos oxiácidos, serão ionizáveis somente os hidrogênios ligados ao oxigênio.
Por exemplo, o HCl possui apenas um hidrogênio ionizável:
1 HCl(aq) + 1 H2O(?) → 1 H3O+(aq)+ 1 Cl-(aq)
Já o ácido bórico H3BO3 possui três hidrogênios ionizáveis:
1 H3BO3 (aq) + 3 H2O(?) → 3 H3O+(aq)+ 1 BO33-(aq)
Apesar de possuir só um hidrogênio ionizável, o ácido clorídrico forma com a água um ácido forte e corrosivo. No caso do ácido bórico, apesar de ele liberar três hidrogênios ionizáveis, ele forma com a água um ácido fraco.
Portanto, para sabermos se um ácido é forte ou fraco, temos que olhar mesmo a relação entre as moléculas dissolvidas e as ionizadas.
Videoaula relacionada: