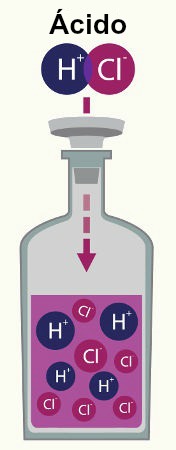
Ácidos são substâncias inorgânicas que, quando dissolvidas em água, sofrem o fenômeno químico da ionização, no qual há a formação de um cátion hidrônio (H3O+ ou H+) e um ânion (X-) qualquer. A reação de ionização de um ácido é representada, de forma geral, por:
HaX + a H2O → a H+ + X-a
ou
HX + H2O → H3O+ + X-
Analisando as equações acima, podemos observar que, em uma equação de ionização de ácidos, sempre vamos ter a presença da água, além do ácido, nos reagentes (à esquerda da seta), bem como do hidrônio com um ânion qualquer nos produtos (à direita da seta).
Para montar uma equação de ionização, podemos seguir alguns passos, que funcionarão com a grande maioria dos ácidos:
-
Passo 1: A carga do hidrônio nunca será diferente de +1;
-
Passo 2: Se o ácido apresentar mais de um hidrogênio ionizável, ele produzirá a mesma quantidade de hidrônios. Por isso, devemos indicar essa quantidade por meio de um coeficiente na frente do hidrônio;
OBS.: Todo hidrogênio de um hidrácido (ácido que não apresenta oxigênio) é ionizável, mas, nos oxiácidos (ácidos que apresentam oxigênio), só é ionizável o hidrogênio que está ligado diretamente a um átomo de oxigênio. Na imagem abaixo, os hidrogênios ionizáveis do oxiácido H2SO4 estão destacados:
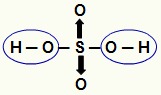
Hidrogênios ionizáveis de um oxiácido
-
Passo 3: O mesmo coeficiente (a) utilizado para indicar a quantidade de hidrônios produzidos deve ser rescrito na fórmula da água;
HaX + a H2O → a H+ + X-a
-
Passo 4: a carga do ânion sempre será igual à quantidade de hidrônios produzidos;
Vamos acompanhar agora a montagem das equações de ionização de alguns ácidos:
Exemplo 1: Ácido cianídrico (HCN)
HCN + 1 H2O → 1 H+ + CN-1
Como o ácido cianídrico possui apenas um único hidrogênio ionizável, teremos a formação de apenas um mol de hidrônio, será utilizado apenas 1 mol de água e o ânion cianeto terá carga -1.
Exemplo 2: Ácido Sulfúrico (H2SO4)
H2SO4 + 2 H2O → 2 H+ + SO4-2
Como o ácido sulfúrico possui três hidrogênios ionizáveis, teremos a formação de dois mols de hidrônio, serão utilizados dois mols de água e o ânion sulfato (SO4) terá carga -2.
Exemplo 3: Ácido Bórico (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
Como o ácido bórico possui três hidrogênios ionizáveis, teremos a formação de três mols de hidrônio, serão utilizados três mols de água e o ânion borato (BO3) terá carga -3.
Exemplo 4: Ácido Pirofosfórico (H4P2O7)
H4P2O7 + 4 H2O → 4 H+ + P2O7-4
Como o ácido pirofosfórico possui três hidrogênios ionizáveis, teremos a formação de quatro mols de hidrônio, serão utilizados quatro mols de água e o ânion pirofosfato (P2O7) terá carga -4.
Exemplo 5: Ácido hipofosforoso (H3PO2)
H3PO2+ 1 H2O → 1 H+ + H2PO2-
Como o ácido fosforoso possui apenas um hidrogênio ionizável, teremos a formação de um mol de hidrônio, será utilizado um mol de água e o ânion hipofosfito (H2PO2) terá carga -1. Abaixo podemos observar por que o ácido hipofosforoso apresenta apenas um hidrogênio ionizável:
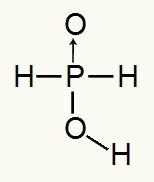
Fórmula estrutural do ácido hipofosforoso
Analisando a fórmula estrutural, podemos perceber que apenas um dos seus três hidrogênios está ligado diretamente ao átomo de oxigênio, por isso, ele só pode apresentar um hidrogênio ionizável.