As reações de dupla troca entre sal (YX) e ácido (HZ) ocorrem sempre que essas substâncias inorgânicas entram em contato. O resultado final é a formação de um novo ácido e um novo sal, como na equação proposta a seguir:
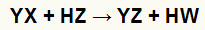
Equação geral de uma reação de dupla troca entre sal e ácido
Podemos observar na equação química acima o padrão fundamental de uma reação de dupla troca entre um ácido e um sal:
-
o cátion do sal (Y+) interage com o ânion do ácido (W-);
-
o cátion do ácido (H+) interage com o ânion do sal (X-).
Para comprovar a ocorrência desse tipo de reação, devemos atentar às seguintes possibilidades:
→ Quando um ácido mais volátil que o do reagente é formado
Quando isso acontece, podemos observar um borbulhamento durante o experimento ou sentir o odor do ácido. É importante ressaltar que o ácido volátil é aquele que passa do estado líquido para o estado gasoso em temperatura ambiente.
Exemplos:
1º) Reação entre o iodeto de potássio (KI) e o ácido sulfúrico (H2SO4)
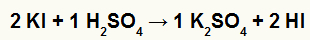
Na reação de dupla troca entre o sal fluoreto de cálcio e o ácido sulfúrico, o sal sulfato de potássio (K2SO4) e o ácido iodídrico (HI), que é um ácido volátil, são formados. Por isso, é importante realizar essa reação em uma capela (exaustor) para evitar que os gases do ácido volátil sejam inalados.
2º) Reação entre o cloreto de potássio (KCl) e o ácido bórico (H3BO3)
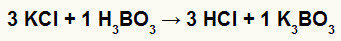
Na reação de dupla troca entre o sal cloreto de potássio e o ácido bórico, o sal borato de potássio (K3BO3) e o ácido clorídrico (HCl), que é um ácido volátil, são formados.
→ Quando um ácido mais instável que o do reagente é formado
Os ácidos instáveis são o tiossúlfúrico (H2S2O3), carbônico (H2CO3) e sulfuroso. Quando são formados, transformam-se em novas substâncias:
-
Ácido tiossúlfúrico transforma-se em água, gás dióxido de enxofre e enxofre sólido;
-
Ácido carbônico transforma-se em água e no gás dióxido de carbono;
-
Ácido sulfuroso transforma-se em água e no gás dióxido de enxofre.
Assim, quando um ácido instável é formado em uma dupla troca entre sal e ácido, percebemos um borbulhamento no recipiente, já que todos eles se convertem em gás.
Exemplos:
1º) Reação entre o carbonato de sódio (Na2CO3) e o ácido clorídrico (HCl)
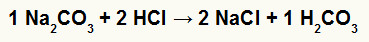
Na reação de dupla troca entre o sal carbonato de sódio e o ácido clorídrico, o sal cloreto de sódio (NaCl) e o ácido carbônico (H2CO3), que é um ácido instável, são formados. A formação do gás carbônico a partir do ácido carbônico causa borbulhamento no experimento.
2º) Reação entre o tiossulfato de cálcio (CaS2O3) e o ácido fluorídrico (HF)
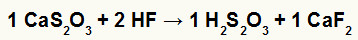
Na reação de dupla troca entre o tiossulfato de cálcio e o ácido fluorídrico, o sal fluoreto de cálcio (CaF2) e o ácido tiossulfúrico (H2S2O3), que é um ácido instável, são formados. A formação do gás dióxido de enxofre a partir do ácido tiossulfúrico causa borbulhamento no experimento.
→ Quando um sal praticamente insolúvel é formado
Quando uma reação de dupla troca entre sal e ácido é realizada, utiliza-se uma solução aquosa de um sal e uma solução aquosa de um ácido. Se um sal praticamente insolúvel for formado, teremos como consequência a deposição de um sólido no fundo do recipiente. Na tabela de solubilidade a seguir, temos as situações em que um sal é praticamente insolúvel:
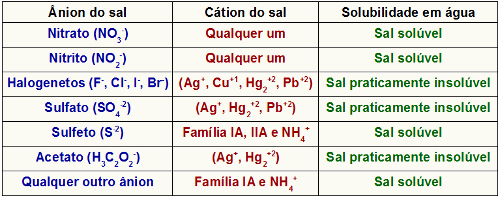
Exemplos:
1º) Reação entre o nitrato de prata (AgNO3) e o ácido clorídrico (HCl)

Quando o sal nitrato de prata reage com o ácido clorídrico, temos uma reação de dupla troca que origina sal cloreto de prata (AgCl) – o ânion Cl com a prata forma sal praticamente insolúvel – e o ácido nítrico (HNO3). Nessa reação, há deposição de um sólido no fundo do recipiente, já que o cloreto de prata é praticamente insolúvel em água.
2º) Nitrito de chumbo II [Pb(NO2)2] e ácido iodídrico (HI)

Quando o sal nitrito de chumbo II reage com o ácido iodídrico, temos uma reação de dupla troca que origina sal iodeto de chumbo II (PbI2) – ânion I com o chumbo II forma sal praticamente insolúvel – e o ácido nitroso (HNO2). Nessa reação, há deposição de um sólido no fundo do recipiente, já que o iodeto de chumbo II é praticamente insolúvel em água.
→ Quando um ácido formado é mais fraco que o do reagente
Nesse tipo de dupla troca, visualmente, não há nenhuma modificação. Todavia, se compararmos um teste de condutibilidade elétrica nas soluções do sal e do ácido antes da reação com outro teste após a reação, será constatada uma redução na condutibilidade elétrica. Isso ocorre quando o ácido formado é mais fraco que o ácido do reagente
Temos um ácido fraco nas seguintes situações:
-
Hidrácido (ácido sem oxigênio): ácido iodídrico (HI), bromídrico (HBr) e clorídrico (HCl);
-
Oxiácido (ácido com oxigênio): quando a subtração entre número de oxigênios e número de hidrogênios é igual a 0. Se superior a 1, o ácido é forte.
Exemplos:
1º) Reação entre o cianeto de sódio (NaCN) e o ácido bromídrico (HBr)
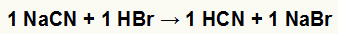
Quando o sal cianeto de sódio reage com o ácido bromídrico, temos uma reação de dupla troca que resulta em sal brometo de sódio (NaBr) e ácido cianídrico (HCN), um hidrácido fraco. Em virtude da presença de um ácido mais fraco que o do reagente, o teste de condutibilidade após a reação será inferior ao realizado antes dela.
2º) Reação entre o borato de potássio (K3PO4) e o ácido sulfúrico (H2SO4)

Quando o sal borato de potássio reage com o ácido sulfúrico (ácido forte, pois a subtração de oxigênios e hidrogênios é igual a 2), temos uma reação de dupla troca que resulta em sal sulfato de potássio (K2SO4) e ácido fosfórico (H3PO4), que é um oxiácido moderado, pois, subtraindo os quatro oxigênios pelos três hidrogênios, o resultado é 1. Em virtude da presença de um ácido mais fraco que o do reagente, o teste de condutibilidade após a reação será inferior ao realizado antes dela.