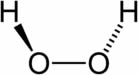Óxidos são substâncias que possuem oxigênio ligado a outro elemento químico, eles são compostos binários, ou seja, formados pela combinação de dois elementos. Um desses elementos é sempre o oxigênio (O).
Os óxidos podem ser classificados em diferentes grupos: ácidos, básicos, neutros, duplos, peróxidos ou anfóteros.
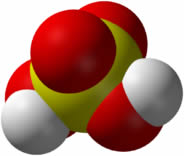
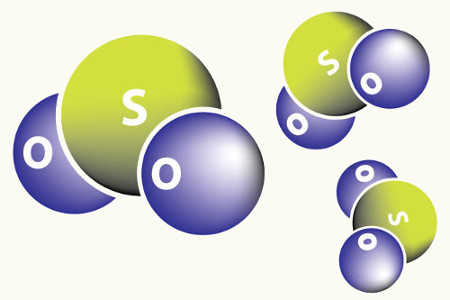
Óxidos ácidos: se formam a partir da reação com água originando ácidos também chamados de anidridos. Exemplo: o ácido sulfúrico (H2SO4) se forma a partir do trióxido de enxofre (SO3) em presença de água (H2O).
Óxidos básicos: a reação é feita a partir de bases levando à formação de sal e água. Exemplo: o hidróxido de cálcio (Ca (OH)2) provém da reação do óxido de cálcio (CaO) com a água.
Óxidos neutros: são formados por ametais, portanto são covalentes e não reagem com água, ácido ou base.
Óxidos duplos ou mistos: são resultantes da combinação de dois óxidos de um mesmo elemento.
Peróxidos: esses óxidos possuem dois oxigênios ligados entre si. Exemplo: (O-O)2-.
Óxidos anfóteros: se comportam como óxidos básicos na presença de ácidos e como óxidos ácidos na presença de bases.
Utilizações dos Óxidos:
- Óxido de Cálcio (CaO): É usado na agricultura para diminuir a acidez do solo e também na preparação de argamassa na construção civil.
- Óxido Nitroso (N2O): Utilizado como anestésico, também conhecido como gás hilariante. Esse óxido inalado em pequena quantidade provoca euforia, mas pode causar sérios problemas de saúde.
- Dióxido de Enxofre (SO2): É usado no branqueamento de óleos alimentícios, entre outras aplicações. É um dos principais poluentes atmosféricos; em dias úmidos, combina-se com o vapor de água da atmosfera e origina a chamada chuva ácida.
- Monóxido de Carbono (CO): Usado na metalurgia do aço. É normalmente o principal poluente da atmosfera das zonas urbanas.
- Peróxido de hidrogênio (H2O2): A solução aquosa com concentração de 3% de peróxido de hidrogênio, popularmente conhecida como água oxigenada, é usada como anti-séptico e algumas pessoas a utilizam para a descoloração de pêlos e cabelos. Na indústria, os peróxidos são usados como clarificadores (alvejantes) de tecidos, poupa de celulose, etc. Para essas utilizações sua concentração é superior a 30% de peróxido de hidrogênio.
Aproveite para conferir nossas videoaulas sobre o assunto: