A chuva ácida é um problema ambiental de grande preocupação cuja raíz está na poluição do ar. A presença de determinados poluentes na atmosfera faz com que a chuva atinja menores valores de pH que o convencional, tornando a água da chuva mais ácida, o que acarreta problemas em diversos setores sociais e econômicos. A chuva ácida impacta a saúde dos seres humanos e demais animais, as estruturas arquitetônicas, além do equilíbrio de solos, matas e corpos hídricos.
A chuva ácida é causada basicamente pela presença de gases de enxofre e nitrogênio na atmosfera, oriundos de atividade antropogênica. Graças às condições oxidantes em camadas da atmosfera, esses gases se convertem em substâncias de caráter ácido que, ao se dissolverem nas gotículas da chuva, aumentam a concentração de íons H+. A chuva ácida é um problema global, atingindo principalmente países densamente povoados ou com alta atividade industrial.
Tópicos deste artigo
- 1 - Resumo sobre chuva ácida
- 2 - O que é chuva ácida?
- 3 - Principais causas da chuva ácida
- 4 - Formação da chuva ácida
- 5 - Composição da chuva ácida
- 6 - Consequências da chuva ácida
- 7 - Chuva ácida no Brasil
- 8 - Chuva ácida no mundo
Resumo sobre chuva ácida
- A chuva ácida é um problema relacionado com a diminuição do valor de pH da água da chuva.
- Está relacionada à maior presença de determinados poluentes na atmosfera.
- Tais poluentes formam compostos ácidos por meio de reações químicas e que, ao se dissolverem nas gotas de água das chuvas, aumentam a concentração de íons H+.
- Entre os principais acidificadores da chuva estão os gases de enxofre e de nitrogênio.
- A chuva ácida impacta o equilíbrio da fauna e da flora, pois altera a composição química de corpos hídricos e solos.
- Diversos animais, incluindo os humanos, acabam impactados direta ou indiretamente pela acidificação da chuva.
- As chuvas ácidas também causam danos estruturais em edificações, causando grande custo nos países afetados.
- A chuva ácida é um problema global, afetando diversos países, entre eles o Brasil.
O que é chuva ácida?
A chuva ácida é um tema relacionado com a poluição do ar e de grande discussão na sociedade. Basicamente, podemos dizer que o fenômeno da chuva ácida é uma chuva convencional acidificada por certos poluentes atmosféricos.
A chuva convencional, formada dos vapores de água que se condensam nas nuvens, se inicia com pH neutro. Conforme a precipitação evolui e as gotículas trafegam no ar, a água vai dissolvendo substâncias químicas presentes na atmosfera e transportando consigo partículas suspensas no ar.
Em condições de ar limpo, apenas substâncias que ocorrem naturalmente são dissolvidas ou carregadas, tais como poeira, pólen e um pouco de dióxido de carbono, CO2, e alguns outros compostos formados pelos raios e vulcões.
Essas substâncias acabam tornando o pH da chuva levemente ácido, na faixa de 5,7, um nível seguro de acidez. Tal valor de pH se dá muito por conta da formação do ácido carbônico, H2CO3, por meio da reação da água com o dióxido de carbono. Na sua dissociação, há a formação de íons H+, responsáveis por diminuir o pH.
H2O + CO2 ⇌ H2CO3
H2CO3 ⇌ H+ + HCO3−
HCO3− ⇌ CO32− + H+
Há também a possibilidade de pequena formação de ácido nítrico, HNO3, por conta da oxidação do gás nitrogênio pela ação do gás oxigênio, na presença de água, durante tempestades de raios.
2 N2 + 5 O2 + 2 H2O → 4 HNO3
HNO3 → H+ + NO3−
Caso a concentração de íons H+ seja suficientemente grande para que o pH seja menor que 5,6, já podemos concluir que se trata de uma chuva ácida.
Principais causas da chuva ácida
Como apontado, são poluentes atmosféricos específicos que conseguem intensificar a acidez da chuva. Entre eles, os principais são compostos de enxofre, com destaque para o dióxido de enxofre (SO2), gases de nitrogênio (NOX) e o ozônio (O3).
Outros acidificantes da chuva são o gás cloro (Cl2) e o ácido clorídrico (HCl), além de ácidos orgânicos, como ácido fórmico, ácido acético, ácido propanóico, ácidos carboxílicos mais pesados (com seis ou mais carbonos, por exemplo), além de ácido fosfórico e ácido tricloroacético.
Embora alguns desses poluentes possam ter origens naturais, como na queimada de florestas, ou por meio de atividade vulcânica, não há como negar que a contribuição humana é muito mais significante que qualquer contribuição natural para a acidificação da chuva.
Por exemplo, o óxido de enxofre pode ser naturalmente formado em mares e oceanos, em atividades vulcânicas, além de processos biológicos que ocorrem no solo, como a decomposição da matéria orgânica. A maior contribuição desse gás na atmosfera se dá por meio da queima de carvão, da produção de petróleo, da produção industrial de ácido sulfúrico, da indústria metalúrgica e de processos químicos industriais diversos.
Da mesma forma, os gases de nitrogênio têm origem natural nos raios, nas erupções vulcânicas e em outros processos biológicos. Contudo, boa parte da sua concentração na atmosfera é consequência das usinas de energia, dos escapamentos de veículos e das indústrias de modo em geral.
Leia mais: Reações de enxofre na atmosfera
Formação da chuva ácida
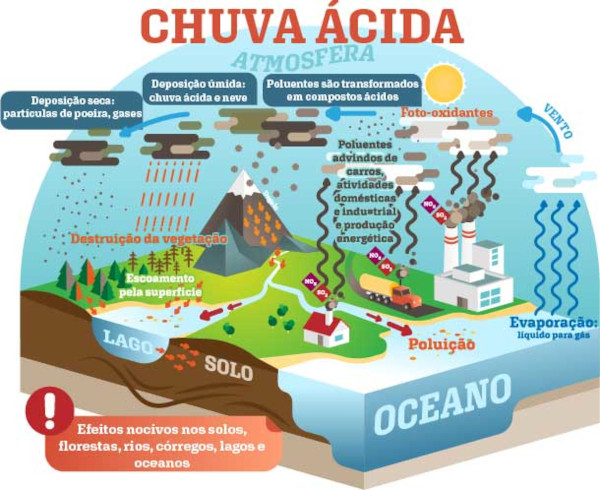
Basicamente, a formação da chuva ácida se dá por seis etapas:
- A atmosfera recebe cargas de óxidos de enxofre e nitrogênio provenientes de fontes naturais e antropogênicas.
- Na ausência de nuvens, alguns desses óxidos acabam voltando diretamente ao solo via deposição seca, seja perto do seu ponto de origem, seja mais distante.
- A luz solar estimula a formação de foto-oxidantes na atmosfera, como o gás ozônio.
- Os foto-oxidantes, interagindo com os óxidos de enxofre e nitrogênio, formam H2SO4 e HNO3 via oxidação.
- Tais compostos são dissolvidos nas gotículas de água das nuvens e da chuva, produzindo íons H+ pela dissolução das espécies formadas na etapa anterior.
- Os compostos então dissolvidos são depositados no solo por meio da chuva.
Composição da chuva ácida
A composição química da chuva ácida é consequência de uma grande possibilidade de reações químicas que ocorrem na atmosfera, as quais justificam a formação de compostos acidificantes da chuva. A seguir, serão apresentadas algumas.
- Reações ácidas envolvendo o ozônio:
O3 → O2 + O
O + H2O → 2 OH• (radical hidróxido)
OH• + SO2 → HSO3−
HSO3− + OH• → H2SO4
OH• + NO2 → HNO3
HSO3− + O2 → SO32− + HO2• (radical peróxido)
Os radicais peróxido acabam por reagir com o formaldeído e o acetaldeído, dando origem aos ácidos fórmico e acético, além de outros ácidos orgânicos, os quais também contribuem de maneira significativa para a carga ácida da chuva.
- Reações ácidas envolvendo o enxofre:
O carvão é rico em enxofre, assim, sua queima forma o dióxido de enxofre.
S + O2 → SO2
Assim sendo, o SO2 vai sendo carregado pelo vento e se dissolve em água.
SO2 + H2O → H2SO3
H2SO3 → H+ + HSO3−
HSO3− + O3 → SO42− + H+ + O2
HSO3− → H+ + SO32−
SO2 + O3 → SO3 + O2
SO3 + H2O → H2SO4
H2SO4 → H+ + HSO4−
HSO4− → H+ + SO42−
- Reações ácidas envolvendo o nitrogênio:
N2 + O2 → 2 NO
2 NO + O2 → 2 NO2
SO2 + NO2 → SO3 + NO
4 NO2 + O2 + 2 H2O → 4 HNO3
O3 + NO2 → NO3 + O2
NO3 + NO2 → N2O5
N2O5 + H2O → HNO3
HNO3 → H+ + NO3−
Consequências da chuva ácida
-
Consequências da chuva ácida em ecossistemas aquáticos
Nos corpos hídricos, metais como zinco, cádmio, níquel, manganês, cromo, cobre e mercúrio formam complexos com fosfatos e com ácido fúlvico, diminuindo sua disponibilidade e, consequentemente, a toxicidade desses metais.
Isso porque quanto maior o pH (mais básico ou menos ácido), menor a solubilidade desses complexos. A queda do pH faz com o que complexo com fosfato e ácido fúlvico seja desestabilizado, colocando íons desses metais em solução. A redução do pH também faz com que metais de sedimentos se solubilizem em água. Com isso, há um aumento da concentração de metais tóxicos em água, sendo nocivos aos organismos aquáticos.

Quando o pH da água é inferior a 5,5, o número e a diversidade de espécies são reduzidos, além de haver prejuízo na reprodução e, consequentemente, eliminação de espécies, como fitoplânctons, zooplanctons, moluscos e anfípodes.
Por outro lado, espécies invertebradas que toleram mais o pH ácido acabam predominantes. Caso o pH continue caindo (abaixo de 5,0), boa parte das espécies de peixes será eliminada, e, com pH inferior a 4,5, boa parte das algas não conseguirá sobreviver.
-
Consequências da chuva ácida nos solos
Alguns metais, como alumínio e chumbo, estão presentes no solo na forma de óxidos insolúveis em água. O aumento da acidez favorece a solubilização desses metais, afetando assim as plantas ou sendo levados pela água da chuva para rios e lagos. A maior acidez no solo aumenta a troca entre íons hidrogênio e cátions nutrientes, como cálcio, potássio e magnésio.
Tais cátions acabam sendo liberados no solo e são rapidamente lixiviados do solo pela ação do sulfato oriundo das espécies ácidas, ocasionando uma queda de nutrientes no solo e, consequentemente, menor fertilidade e menor crescimento de plantas. A maior acidez também dificulta a decomposição da biomassa presente no solo.
Contudo, solos são mais resistentes ao aumento da concentração ácida do que as águas, por conta da capacidade tamponante.
-
Consequências da chuva ácida na agricultura
A chuva ácida aumenta a concentração de metais pesados, tais como cobre, cádmio, chumbo e zinco, em plantações. É possível perceber que, em algumas regiões que sofrem mais com esse problema, os vegetais colhidos apresentam maior concentração desses metais, os quais são perigosos para a saúde dos seres humanos e demais animais.
-
Consequências da chuva ácida nas construções

A chuva ácida acelera o intemperismo químico e a corrosão de construções que estão ao ar livre. Por exemplo, estruturas metálicas ferrosas, como prédios e trilhos de trem, são seriamente afetadas pela chuva ácida, uma vez que os metais são atacados pelo SO2, acelerando o processo de enferrujamento.
Construções que utilizam pedras à base de calcário, como mármore e arenito, têm grande concentração de carbonato de cálcio. Tal composto reage com o ácido sulfúrico presente na chuva ácida, formando sulfato de cálcio, o qual é granular e é lavado a cada chuva, expondo o carbonato de cálcio interno a novas cargas ácidas.
-
Consequências da chuva ácida na saúde humana
Para os seres humanos, a elevação da acidez na chuva traz problemas relacionados a maus odores, redução da visibilidade, além de irritação da pele, dos olhos e do trato respiratório. Alguns efeitos diretos incluem bronquite crônica, enfisema pulmonar e até mesmo câncer.
Indiretamente, o envenenamento por alimentação ou por ingestão de água, já que a elevação dos níveis de metais tóxicos, como manganês, cobre, cádmio, alumínio e cromo, afeta a saúde humana. Tais metais também podem se acumular, por conta da ingestão contínua de alimentos e água infectados, em nosso organismo.
Chuva ácida no Brasil
Estudos do começo do século XXI apontam chuvas com valores médios de pH entre 4,5 e 5,5 em diversas regiões do Brasil, havendo apenas variedade da composição dos íons presentes na atmosfera.
Por exemplo, na região amazônica, com menor atividade humana, há menor quantidade de teores iônicos, diferentemente do Rio de Janeiro e de Ilha Grande, onde os teores de sódio e cloreto são mais elevados por conta da influência marítima. Na década de 1980, Cubatão, região de alta intensidade industrial de São Paulo, apresentava chuvas muito ácidas, com concentrações de íons sulfato 10 vezes maiores que as da capital paulista.
Em 2017, a chuva ácida se mostrou responsável pela mortandade de peixes no Rio Pirapó, em Maringá, no norte do Paraná. Na ocasião, a ausência de chuvas (por 38 dias) fez aumentar a concentração de poluentes, diminuindo assim o pH da chuva. O Rio Pirapó é responsável por cerca de 80% do abastecimento de água da cidade de Maringá.
Um estudo mais recente, de 2020, aponta que a chuva ácida tem se tornando um problema de maior impacto na região Sudeste, dadas a grande frota de veículos automotores e a maior densidade de atividade industrial. Valores de pH entre 3,5 e 4,0 foram reportados para chuvas em grandes cidades, como Rio de Janeiro e São Paulo.
Assim sendo, a Mata Atlântica é um dos biomas mais afetados com a deposição ácida. Em Minas Gerais, por exemplo, chuvas ácidas vêm sendo detectadas mesmo em regiões de proteção ambiental, como no Parque Estadual do Rio Doce, provavelmente por influência das atividades de fábricas de aço e por conta da queima de carvão mineral.
Chuva ácida no mundo
Países com maior desenvolvimento de atividade industrial e econômica, como EUA, países da Europa e China, enfrentam grandes problemas em relação à acidez da chuva. Atualmente, índices de pH das chuvas da Europa, como Dinamarca e Alemanha, assim como do Canadá, na América do Norte, ficam entre 4,2 e 4,5. Já nos EUA, os valores de pH ficam em torno de 4,8.
Outros países europeus, como Áustria, Bielorrúsia, Croácia, Finlândia, Irlanda, Itália, Noruega, Suécia e o Reino Unido, apresentam um pH médio de 4,8 para as águas da chuva, com alta concentração de íons sulfato, cloreto e nitrato.
No centro-sul da Ásia, dado o crescimento industrial e populacional da região, percebe-se uma piora dos índices de qualidade do ar. Estima-se que a chuva ácida atue sobre dois milhões de quilômetros quadrados do território chinês, sendo que, em 44 cidades chinesas, o pH médio da chuva está em 5,6, apresentando valores mínimos de até 3,8. No Japão, perto do mar, há leituras de pH médio da chuva entre 4,7 e 5,3.

Em 2018, a Organização Mundial da Saúde (OMS) reportou que diversas cidades indianas, como Kanpur, Faridabad, Gaya, Varanasi e Patna, estariam entre as mais poluídas do mundo em termos de poluição do ar. Cidades metropolitanas, como Mumbai, Delhi, Kolkata e Chennai, assim como cidades próximas a regiões industriais, apresentavam evidências de chuva ácida.
Fontes
ABBASI, T.; POORNIMA, P.; KANNADASAN, T.; ABBASI, S. Acid rain: past, present and future. International Journal of Environmental Engineering. v. 5, n. 3, p. 229-272, 2013.
ANDRADE, G. C.; CASTRO, L. N.; DA SILVA, L. C. Micromorphological alterations induced by simulated acid rain on the leaf surface of Joannesia princeps Vell. (Euphorbiaceae). Ecological Indicators. v. 116. set. 2020.
BALLARD, B. The cost of restoring Italy’s historic landmarks. Business Destinations. 28 fev. 2018. Disponível em: https://www.businessdestinations.com/featured/rome-wasnt-rebuilt-in-a-day-restoring-italys-landmarks/.
CARDOSO, R. K. O. A.; SILINGARDI, H. M. T.; CARDOSO, A. A. Gases ácidos na atmosfera: fontes, transporte, deposição e suas consequências para o ambiente. Química Nova Na Escola. v. 42, n. 4, p. 382-385, nov. 2020.
FORNARO, A. Águas de chuva: conceitos e breve histórico. Há chuva ácida no Brasil? Revista USP. n. 70, p. 78-87, jun-ago. 2006.
HISING, E.; LINJARDI, F. Chuva ácida e poluição matam peixes no Rio Pirapó, em Maringá, diz IAP. G1. 29 set. 2017. Disponível em: https://g1.globo.com/pr/norte-noroeste/noticia/chuva-acida-e-poluicao-matam-peixes-no-rio-pirapo-diz-iap.ghtml.
PRAKASH, J.; AGRAWAL, S. B.; AGRAWAL, M. Global Trends of Acidity in Rainfall and Its Impacts on Plants and Soil. Journal of Soil Science and Plant Nutrition. V. 23, n. 1, p. 398-419, 2023.
SINGH, A.; AGRAWAL, M. Acid rain and its ecological consquences. Journal of Environmental Biology. v. 29, n. 1, p. 15-24, 2008.
UNITED NATIONS ECONOMIC COMISSION FOR EUROPE. Dirty air endangers UNESCO World Heritage Sites and produces high costs. UNECE. 10 mai. 2020. Disponível em: https://unece.org/media/press/1414.










