Os sabões e os detergentes são compostos constituídos por longas cadeias carbônicas apolares, com uma extremidade polar. A figura a seguir representa uma estrutura típica de um sabão:
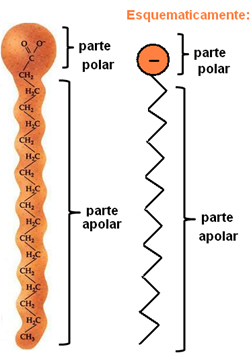
Representação da estrutura química dos sabões.
Os detergentes possuem estrutura bastante semelhante, porém o grupo da extremidade apresenta carga positiva, sendo denominado detergente catiônico; ou carga negativa, sendo, então, um detergente aniônico. Eles são sais derivados de ácidos carboxílicos e o mais comum é o detergente aniônico lauril sulfato de sódio [H3C[CH2]11OSO3]-[Na]+, mostrado a seguir:
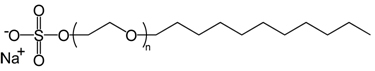
Representação da estrutura química de um dos principais detergentes, o lauril sulfato de sódio.
Mas o que faz com que os detergentes tenham a capacidade de remover a gordura de objetos sujos enquanto que a água sozinha não tem essa capacidade?
Bom, a água é uma substância polar e as gorduras são apolares. Assim, a água não consegue interagir com as gorduras, pois não tem afinidade com elas. Além disso, a água possui uma tensão superficial que a impede de penetrar em certos tipos de tecidos e outros materiais. Porém, aí surge outra pergunta: o que é essa tensão superficial?
As moléculas de água se atraem mutuamente e, como existem moléculas para todos os lados, essa atração, denominada força de coesão, ocorre em todas as direções; exceto no que tange às moléculas da superfície. Visto que essas moléculas não têm outras moléculas de água acima delas, as suas forças de coesão para os lados e para baixo se intensificam, criando, assim, uma espécie de película na superfície da água, que é a tensão superficial.
Essa tensão superficial é a responsável por mosquitos conseguirem se deslocar por cima da água. É responsável também por materiais leves, como agulhas e moedas, flutuarem na água e, além disso, a tensão superficial constitui um dos fatores que dificultam a limpeza somente com o uso da água.
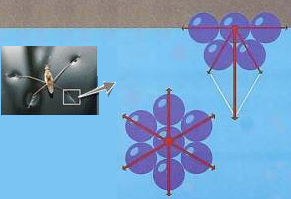
Tensão superficial da água.
E como os detergentes e os sabões resolvem essa questão da tensão superficial e da polaridade?
Conforme dito, eles possuem duas partes distintas em sua estrutura, sendo que a parte polar é também hidrofílica, ou seja, possui afinidade com a molécula de água, porém não interage com as moléculas da gordura. Já na parte apolar ocorre exatamente o contrário, pois é uma parte hidrofóbica – não interage com a água, mas tem afinidade com as moléculas de gordura.
Assim, o que acontece é que quando adicionadas na água, as moléculas dos detergentes se distribuem ao redor das moléculas de gordura, formando pequenos glóbulos, denominados micelas. A parte apolar das moléculas do detergente fica voltada para o interior do glóbulo, em contato com a gordura; enquanto que a parte hidrofílica ou polar fica voltada para o exterior, em contato com a água. Dessa forma, quando se “arrastam” as micelas de detergente, removem-se também a gordura junto, pois ela estará aprisionada na parte hidrofóbica, isto é, na região central da micela.
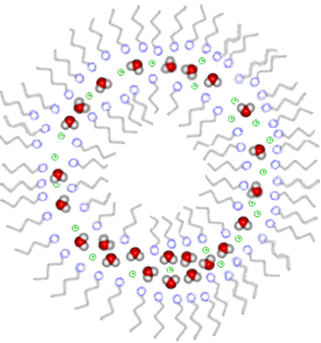
Micela formada por moléculas de detergente dispersas em água.
No que diz respeito à tensão superficial da água, os detergentes têm a capacidade de diminuir essa tensão, facilitando, assim, com que a água penetre em vários materiais para remover a sujeira. É por isso que o sabões e os detergentes são chamados de agentes tensoativos ou surfactantes, sendo que essa última palavra vem do inglês surface active agents = surfactants.
Esse é um dos fatores que ameaçam o meio ambiente, pois quando os detergentes são despejados em rios e lagos, o deslocamento dos insetos sobre a água é dificultado, o que pode diminuir a população de insetos e causar um desequilíbrio no ecossistema.












