O carbono é a unidade fundamental dos compostos orgânicos, tanto que a Química Orgânica é definida como a área que estuda os compostos desse elemento, com propriedades características. A estrutura desses compostos começou a ser desvendada no século XIX, quando a principal preocupação dos cientistas não era descobrir a composição das substâncias, mas sim como os elementos se ligavam para formá-las.
Entre 1858 e 1861, os químicos Friedrich Kekulé (1829-1896), Archibald Scott Couper (1831-1892) e Alexander M. Betherov (1828-1886) lançaram ideias de forma independente que explicavam o comportamento do carbono, sendo que dessas ideias foram propostos os três postulados a seguir, que servem como bases fundamentais para os princípios da Química Orgânica:
1º Postulado: O carbono é tetravalente: Isso significa que ele tem a capacidade de realizar quatro ligações covalentes, que podem ser simples, duplas ou triplas;
2º Postulado: As quatro ligações que o carbono realiza são iguais, isto é, equivalentes e coplanares;
3º Postulado: O carbono é capaz de formar cadeias carbônicas, que podem conter até milhares de átomos de carbono ligados.

Friedrich August Kekulé von Stradonitz (1829-1896)
No ano de 1874, Van’t Hoff e Le Bel criaram um modelo espacial para o carbono, em que os seus átomos eram representados por tetraedros com o carbono no centro e suas quatro valências sendo os vértices do tetraedro. Cada tipo de ligação (simples, dupla e tripla) era representado com arranjos espaciais diferentes, como mostrado abaixo:
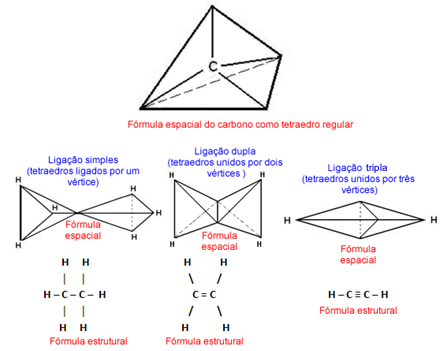
Fórmula espacial do carbono, segundo Van’t Hoff e Le Bel, representada por tetraedros regulares
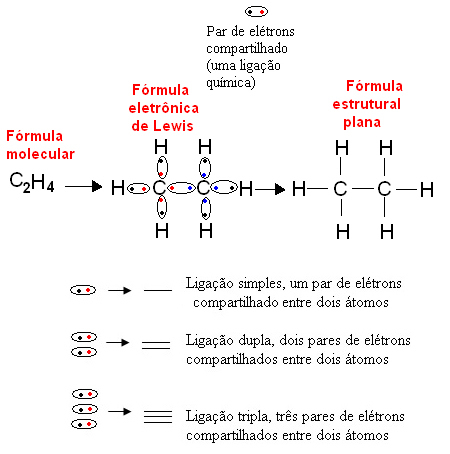
Em 1916, o químico norte-americano Gilbert N. Lewis (1875-1946) publicou um trabalho em que cada ligação covalente era representada por um par de elétrons da camada de valência dos átomos que realizavam a ligação. Essa fórmula passou a ser chamada de fórmula eletrônica de Lewis e pode ser vista com mais detalhes no texto Fórmulas Químicas.
Abaixo temos um exemplo desse tipo de representação para um composto orgânico, o etano. Visto que o carbono possui quatro elétrons na sua última camada, seguindo a regra do octeto, ele precisa receber mais quatro elétrons (ficando com oito) para ficar estável. Isso, inclusive, explica o fato de ele ser tetravalente. Já o hidrogênio é monovalente, isto é, só realiza uma ligação covalente. Isso acontece porque ele possui um elétron na sua única camada, que pode conter no máximo dois elétrons, e, em razão disso, ele precisa receber mais um elétron para ficar estável.
Assim, todos os átomos da molécula do etano são escritos por seus símbolos, e ao redor de cada um, são colocados os seus elétrons da camada de valência, que podem ser representados por “bolinhas”. Cada par circulado representa uma ligação covalente, um par de elétrons compartilhado, que pode também ser representado por um traço na fórmula estrutural plana:
Mais tarde, Linus Pauling formulou o modelo da distribuição eletrônica em orbitais, que são regiões na eletrosfera dos átomos onde é máxima a probabilidade de se encontrar o elétron. De forma resumida, esse modelo explicava que os elementos realizam ligações em seus orbitais incompletos (que possuíam apenas um elétron) a fim de preenchê-los. Assim, por exemplo, o elemento que possui um orbital incompleto realiza somente uma ligação, o que possui dois orbitais incompletos realiza duas ligações covalentes, e assim por diante.
.jpg)
Linus Pauling criou o modelo da distribuição eletrônica em orbitais atômicos
No entanto, no caso do carbono, isso não acontece, porque ele realiza quatro ligações, mas só possui dois orbitais atômicos incompletos. Por isso, surgiu um novo modelo para explicar as ligações covalentes que o carbono realiza. Esse modelo é a Teoria da Hibridização, que você poderá conhecer nos textos abaixo:
Hibridização do carbono
Hibridização sp
Hibridização sp2
Videoaula relacionada: