A fórmula molecular de um composto orgânico indica o número de átomos de cada elemento que compõe uma molécula da substância e a proporção entre eles.
Por exemplo, a fórmula molecular do etano é C2H6, isso significa que cada molécula desse composto é formada por dois átomos de carbono e seis átomos de hidrogênio ligados entre si. Visto que o carbono é tetravalente, isto é, realiza quatro ligações para ficar estável, e o hidrogênio é monovalente, fazendo apenas uma ligação covalente, temos que a fórmula estrutural plana do etano é dada por:
H H
| |
H — C — C — H
| |
H H
A fórmula estrutural plana, além de mostrar quais são os elementos químicos que compõem a molécula e o número exato deles, mostra também quais são as ligações que cada um realiza e a estrutura (arrumação ou disposição espacial) dos átomos dentro da molécula.
O carbono pode formar ligações simples, duplas e triplas com outros átomos de carbono e/ou com outros tipos de átomos. É devido a isso que existe uma quantidade muito grande de compostos orgânicos, surgindo o estudo da Química Orgânica. Essas substâncias passaram a ser representadas pelos químicos de diversas formas, mas a mais simples de todas é a fórmula molecular.
Podemos encontrar a fórmula molecular através das outras fórmulas dos compostos orgânicos. Veja como isso é feito em cada caso:
- Fórmula estrutural plana: Basta contar a quantidade em que cada elemento aparece, escrever o símbolo do elemento e o índice no lado inferior direito.
Por exemplo, a seguir, temos a fórmula estrutural plana do pentan-1-ol:
H H H H H
| | | | |
H — C — C — C — C — C — OH
| | | | |
H H H H H
Sempre começamos a contar pelos átomos de carbono, depois vem os hidrogênios ligados a ele e, posteriormente, os demais elementos. Temos nessa molécula 5 átomos de carbono, 11 hidrogênios ligados ao carbono e o grupo funcional dos álcoois “OH”.
Portanto, a fórmula molecular do pentan-1-ol será: C5H11OH, mas pode ser representada também por: C5H12O.
Mas a fórmula estrutural plana pode ser muito longa e complexa, se forem representadas todas as ligações. Por isso, é comum simplificar essa fórmula, condensando algumas ligações. Podem-se condensar as ligações dos hidrogênios e dos carbonos.
- Fórmula Condensada:
- Simplificando a ligação do H: Veja como fazer isso para a mesma molécula de pentan-1-ol:
H3C — CH2 — CH2 — CH2 — CH2 — OH
ou
C — C — C — C — C — OH
H3 H2 H2 H2 H2
Dessa forma, fica até mais fácil de contar a quantidade de hidrogênios, pois basta somar os índices: 3 + 2 + 2 + 2 + 2 = 11 → C5H11OH.
Veja mais exemplos abaixo:
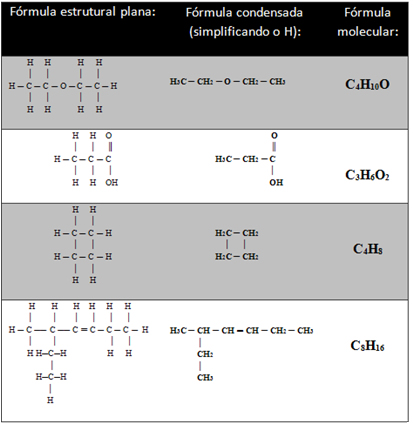
- Simplificando a ligação do C: Usando novamente a molécula de pentan-1-ol:
CH3 — (CH2)3 — CH2 — OH
Multiplicamos o índice de fora dos parênteses pelos de dentro para determinar a quantidade em que cada elemento aparece. Por exemplo, no caso acima, a quantidade de carbonos dentro dos parênteses é 3 (3 . 1) e a quantidade de hidrogênios é 6 (3 . 2). Somando esses valores com os demais, temos:
- C: 1 + 3 + 1 = 5
- H: 3 + 6 + 2 =11
Assim, a fórmula molecular é dada por: C5H11OH.
Na tabela abaixo há outros exemplos:

Mas há ainda um tipo de representação das cadeias carbônicas ainda mais simplificada, que é a mostrada a seguir:
- Fórmula de traços: As ligações entre os carbonos são representadas por traços (uma ligação simples é um traço, uma ligação dupla são dois traços e uma ligação tripla são três traços). As pontas e os pontos de inflexão (os lugares onde dois traços se encontram) correspondem a átomos de carbono.
Um aspecto importante é que nesse tipo de representação a quantidade de hidrogênios fica subentendida, isto é, sabendo que o carbono faz quatro ligações, vemos quantas ligações ele já está realizando. A quantidade que faltar será o número de carbonos ligados a ele.
Por exemplo, a fórmula de traços do propan-1-ol é dada por:
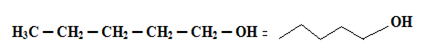
Observe de forma mais detalhada:
.jpg)
Veja mais exemplos:
.jpg)
Aproveite para conferir nossa videoaula sobre o assunto: