Isomeria é o fenômeno que acontece entre alguns compostos que, mesmo tendo a mesma fórmula molecular, ou seja, mesmo número e espécie de átomos, dão origem a substâncias diferentes. As moléculas que são isômeros podem distinguir-se em função, posição de heteroátomo, posição da instauração, estrutura da cadeia carbônica, ou até mesmo pela modificação espacial da estrutura em função de um raio de luz polarizada, que é o caso da talidomida.
Leia também: Temas de Química que mais caem no Enem
Tópicos deste artigo
- 1 - O que é isomeria?
- 2 - Como a isomeria é cobrada no Enem?
- 3 - Tipos de isomeria
- 4 - Questões sobre isomeria no Enem
O que é isomeria?
Isomeria é o fenômeno que acontece quando uma mesma fórmula molecular pode originar compostos diferentes em função, estrutura, arranjo espacial, posição de heteroátomos ou insaturações.
Como a isomeria é cobrada no Enem?
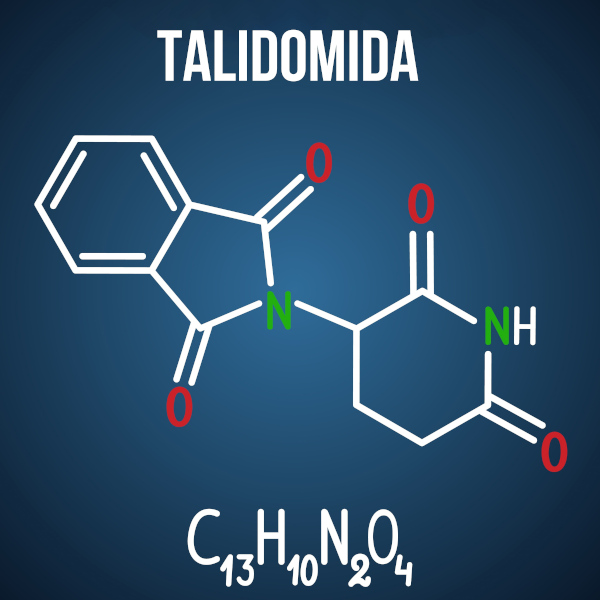
As questões do Enem sobre isomeria fazem associações a casos como o do medicamento talidomida, que, em função da isomeria óptica do composto, causou má formação em mais de 10 mil bebês.
Existem outros produtos, não só do ramo farmacêutico, que possuem em sua estrutura moléculas propensas à isomeria. É possível que, no exame, sejam dadas duas moléculas e peça-se para ser feita a identificação do tipo de isomeria; ou que seja cobrada, do composto isômero de interesse, explicação química sobre possíveis adversidades causadas pela isomeria e a sua interação com o meio; ou, ainda, pode-se pedir o número de isômeros ópticos ativos e inativos em uma determinada substância.
Tipos de isomeria
→ Isomeria plana
-
Isomeria de função
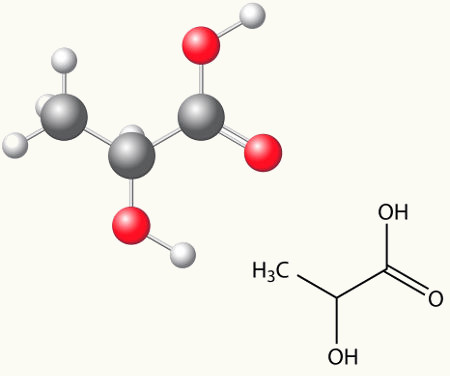
Acontece nesse tipo de isomeria a formação de compostos com funções diferentes e com a mesma fórmula molecular. Esse tipo de isomeria acontece entre as funções álcool e éter; cetona e aldeído; ácido carboxílico e éster. Perceba que são funções que têm algo em comum: dois oxigênios, uma carbonila ou uma carboxila.
Exemplos:
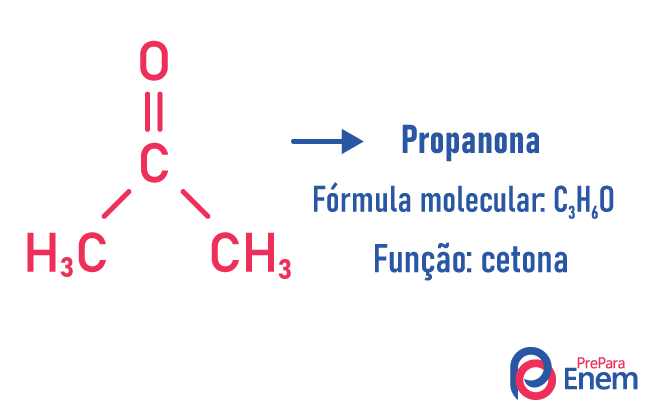
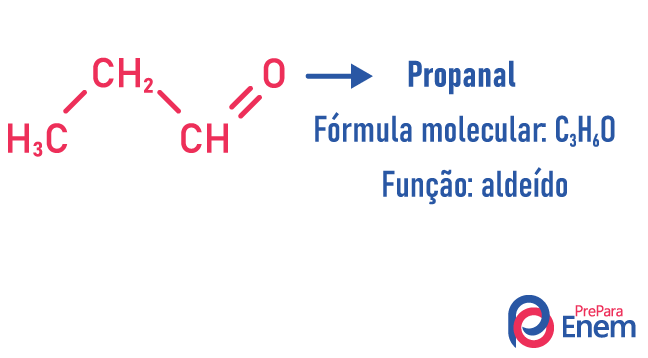
-
Isomeria de cadeia
Nesse caso de isomeria, os compostos diferenciam-se pela estrutura da cadeia. Temos oito classificações para cadeias carbônicas:
- normal
- ramificada
- fechada
- aberta
- homogênea
- heterogênea
- saturada
- insaturada
Uma molécula pode admitir para o mesmo número de átomos estruturas diferentes.
Exemplos:
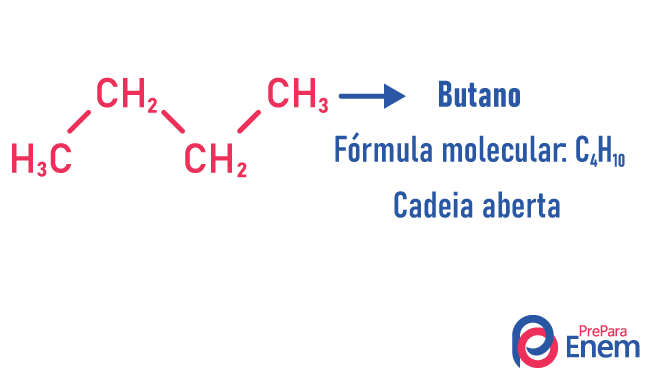
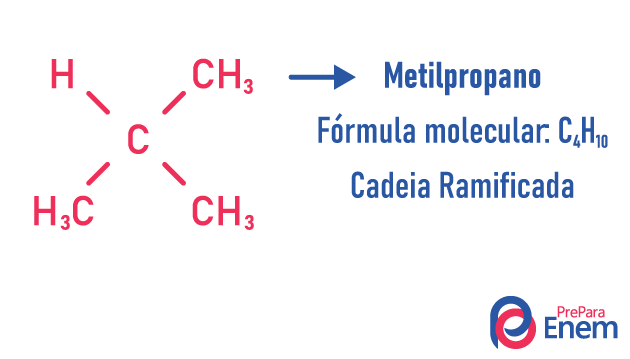
Saiba mais sobre esses tipos de isômeros lendo o nosso texto: Isomeria plana de cadeia.
-
Isomeria de posição
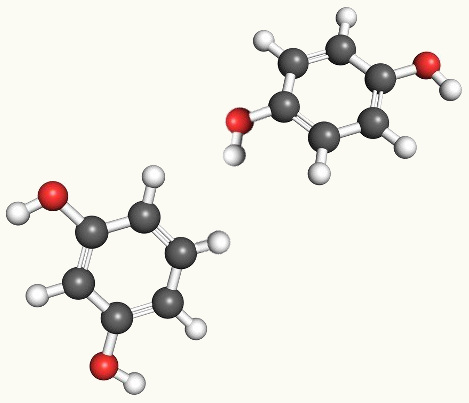
Nesse tipo de isomeria, acontece a diferenciação dos compostos pela posição da insaturação, do heteroátomo, da ramificação, ou, quando possível, do grupo funcional.
Exemplo:
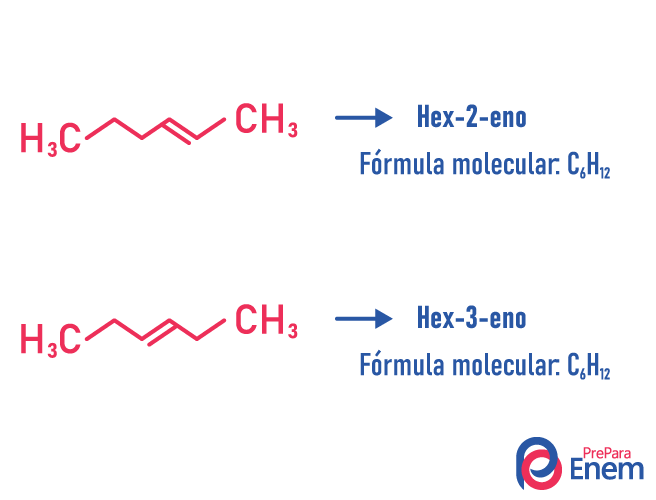
Perceba que a mesma fórmula molecular deu origem a dois compostos com a insaturação em posições diferentes.
Aprenda mais detalhes sobre esse fenômeno acessando o texto: Isomeria plana de posição.
-
Metameria
Nesse tipo de isomeria, o heteroátomo (átomo diferente entre carbonos) muda de posição. Esse tipo acontece em compostos das funções éter e amina.
Atenção! Se o átomo “diferente” for para a extremidade da cadeia, a fim de ocupar uma posição que não seja entre carbonos, não se trata de uma metameria.
Exemplo:
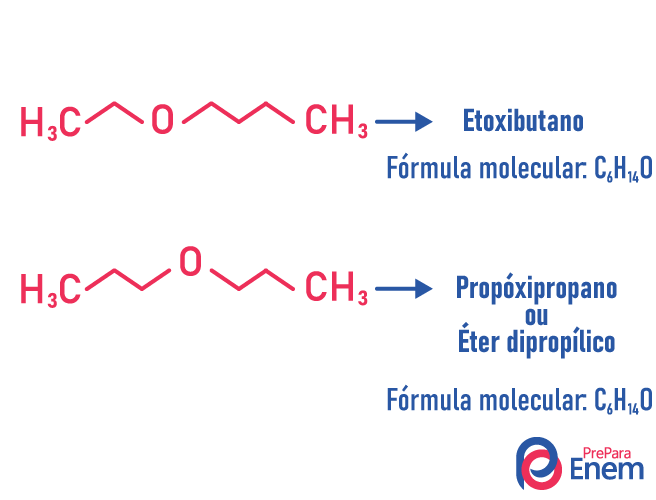
-
Tautomeria
Nesse caso de isomeria, acontece uma movimentação da dupla ligação que estava entre carbonos para um oxigênio vizinho. Isso acontece devido à eletronegatividade do oxigênio que atrairá os elétrons da dupla, liberando, assim, um hidrogênio, que, por estar protonado, entrará no carbono que perdeu a instauração, reavendo o equilíbrio eletrônico da molécula. Nesse tipo de isomeria, acontece a transformação de um álcool em uma cetona ou em um aldeído. Veja no exemplo a seguir:
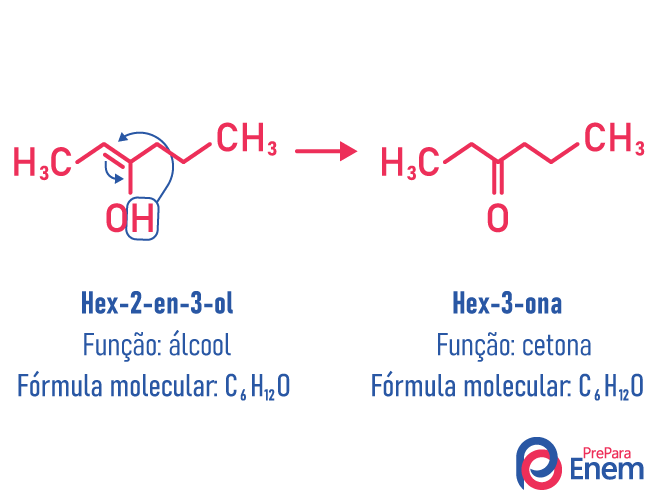
Leia mais informações sobre esse tipo de isomeria plana em: Tautomeria.
→ Isomeria espcial
-
Isomeria geométrica
Esse tipo de isomeria acontece necessariamente em moléculas insaturadas, com uma dupla ligação entre dois carbonos, e os dois ligantes de um mesmo carbono insaturado devem ser diferentes. A isomeria geométrica é dividida em dois tipos: cis e trans. Para melhor diferenciar, podemos traçar uma linha imaginária paralela à ligação dupla, dividindo a molécula ao meio. Se os ligantes iguais ficarem do mesmo lado, teremos isomeria do tipo cis; se não ficarem do mesmo lado, mas em direção “transversal” um do outro, teremos então isomeria do tipo trans.
Veja o exemplo a seguir:
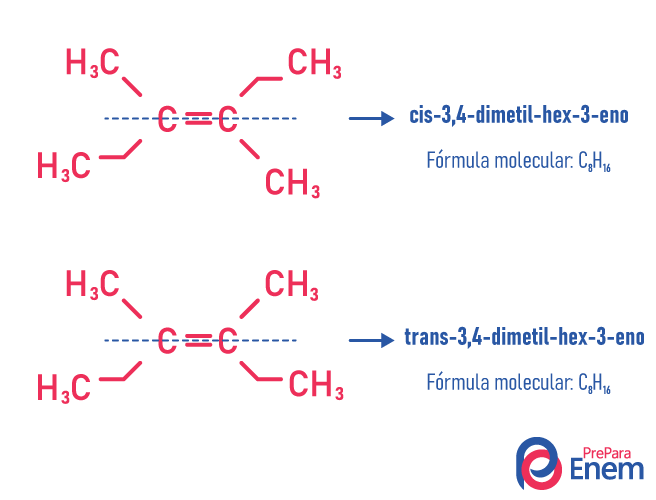
Aprenda mais sobre essa possibilidade de isômeros lendo o texto: Isomeria geométrica ou cis-trans.
-
Isomeria óptica
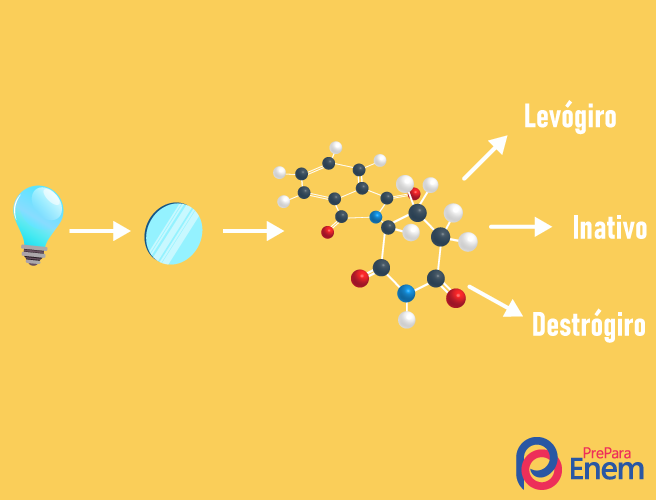
A isomeria óptica acontece exclusivamente com cadeias assimétricas, ou seja, para que tenhamos um caso de isomeria óptica em um determinado composto, é necessário que na molécula haja pelo menos um carbono quiral (carbono com os quatro ligantes diferentes). Esse tipo de isomeria caracteriza-se pela presença de um enantiômero (comportamento de uma molécula pela incidência de uma luz polarizada):
- Dextrógiro: quando a luz é desviada para a direita.
- Levógiro: a luz incidente na molécula é desviada para a esquerda.
- Mistura racêmica: quando a luz polarizada desvia-se igualmente para a direita e para a esquerda, não havendo, assim, desvio óptico, pois um anula o outro.
É possível calcular-se o número de isômeros sabendo o número de carbonos quirais da molécula (n):
- Número de isômeros ópticos ativos: 2n
- Número de isômeros ópticos inativos:
Veja também: Como identificar um carbono quiral?
Questões sobre isomeria no Enem
Questão 1 – (Enem - 2018) Várias características e propriedades de moléculas orgânicas podem ser inferidas analisando sua fórmula estrutural. Na natureza, alguns compostos apresentam a mesma fórmula molecular e diferentes fórmulas estruturais. São os chamados isômeros, como ilustrado nas estruturas.
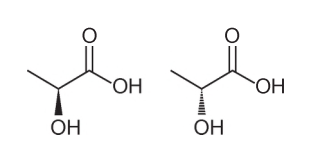
Entre as moléculas apresentadas, observa-se a ocorrência de isomeria
a) ótica.
b) de função.
c) de cadeia.
d) geométrica.
e) de compensação.
Resolução
Alternativa A. Perceba que, em uma molécula, a hidroxila é representada saindo do plano, e, na outra, a mesma hidroxila é representada entrando no plano. Sendo assim, trata-se de uma isomeria óptica, pois não houve alteração de posição, função ou estrutura, mas sim uma alteração espacial em como visualizamos a molécula.
Questão 2 – (Enem) Motores a combustão interna apresentam melhor rendimento quando podem ser adotadas taxas de compressão mais altas nas suas câmaras de combustão, sem que o combustível sofra ignição espontânea. Combustíveis com maiores índices de resistência à compressão, ou seja, maior octanagem, estão associados a compostos com cadeias carbônicas menores, com maior número de ramificações e com ramificações mais afastadas das extremidades da cadeia. Adota-se como valor padrão de 100% de octanagem o isômero do octano mais resistente à compressão.
Com base nas informações do texto, qual entre os isômeros seguintes seria esse composto?
a) n-octano
b) 2,4-dimetil-hexano
c) 2-metil-heptano
d) 2,5-dimetil-hexano
e) 2,2,4-trimetilpentano
Resolução
Alternativa E. Para responder essa questão, devemos procurar entre as alternativas o composto isômero do octano, ou seja, que tenha a mesma fórmula molecular e que tenha em sua estrutura o maior número de ramificações para que, assim, seja resistente à compressão, como dito no enunciado. Entre as alternativas, a que se encaixa nessa descrição é a letra E, tendo três ramificações em sua estrutura e o mesmo número de carbonos e hidrogênios que o octano.
Questão 3 – (Enem 2014) A talidomida é um sedativo leve e foi muito utilizado no tratamento de náuseas, comuns no início da gravidez. Quando foi lançada, era considerada segura para o uso de grávidas, sendo administrada como uma mistura racêmica composta pelos seus dois enantiômeros (R e S). Entretanto, não se sabia, na época, que o enantiômero S leva à malformação congênita, afetando principalmente o desenvolvimento normal dos braços e pernas do bebê.
COELHO, F. A. S. 'Fármacos e quiralídade'. Cadernos Temáticos de Química Nova na Escola, São Paulo, n. 3, maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses enantiômeros:
A) reagem entre si.
B) não podem ser separados.
C) não estão presentes em partes iguais.
D) interagem de maneira distinta com o organismo.
E) são estruturas com diferentes grupos funcionais.
Resolução
Alternativa D. A talidomida sofre isomeria espacial óptica, que é o rearranjo espacial de um dos radicais do carbono quiral. Ainda que seja uma pequena mudança na molécula, é o suficiente para alterar sua interação com o meio, causando os efeitos adversos do medicamento.