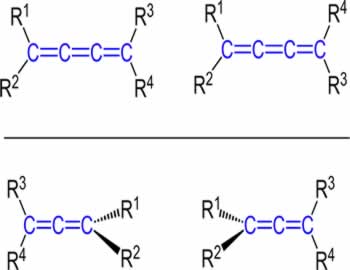
A isomeria espacial geométrica é aquela que só pode ser identificada por meio da consideração da disposição dos átomos da molécula no espaço. Esse tipo de isomeria também é denominado de estereoisomeria e os isômeros de estereoisômeros.
A isomeria geométrica pode ocorrer em cadeias abertas ou fechadas, mas as três condições abaixo devem ser sempre seguidas:
1. Em compostos de cadeia aberta, pelo menos dois átomos de carbono devem possuir uma ligação dupla.
Por exemplo, considere a molécula do but-2-eno abaixo:
H3C CH3
\ /
C ═ C
/ \
H H
Observe que a ligação dupla dessa molécula não permite que os átomos de carbono ligados por ela sofram rotação. Assim, o but-2-eno pode se apresentar de duas formas espaciais, mostradas abaixo:
H3C CH3 H CH3
\ / \ /
C ═ C C ═ C
/ \ / \
H H H3C H
cis-but-2-eno trans-but-2-eno
Observe que, na primeira molécula, os ligantes iguais estão do mesmo lado do plano espacial, por isso esse isômero é denominado de cis, pois essa palavra vem do latim que significa “aquém de” ou “próximo a”. Já na segunda conformação, os ligantes iguais estão em lados opostos do plano, portanto, são chamados de trans, que do latim significa “além de” ou “através de”.

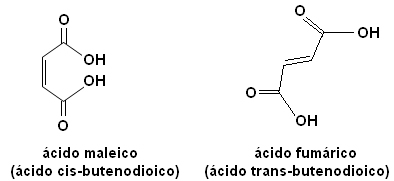
Cada um desses isômeros possui propriedades totalmente distintas. Por exemplo, abaixo temos dois estereoisômeros importantes, o ácido cis-butenodioico (ácido maleico) e o ácido trans-butenodioico (ácido fumárico). O primeiro deles é tóxico, enquanto o segundo é produzido pela nossa pele durante exposição ao sol e participa de processos de produção de energia celular.
Mas por que as moléculas que possuem apenas ligação simples e ligação tripla não realizam esse tipo de isomeria?
As moléculas que possuem apenas ligações simples podem sofrer rotação em seu eixo e, assim, a molécula pode adquirir várias conformações, mas todas são a mesma substância, apenas estão rotacionadas, não formando produtos diferenciados.
Exemplo: a molécula do 1,2-dicloroetano pode adquirir várias conformações, mas continua sendo a mesma, com as mesmas propriedades:
Cℓ Cℓ H Cℓ Cℓ H H H
\ / \ / \ / \ /
C ─ C C ─ C C ─ C C ─ C
/ \ / \ / \ / \
H H Cℓ H H Cℓ Cℓ Cℓ
Todas são a mesma molécula, apenas os carbonos giraram.
A ligação tripla também não propicia a formação de isomeria espacial geométrica porque os átomos de carbono ligados por ela só poderão realizar mais uma ligação. Exemplo: H3C ─ C ≡ C ─ CH3.
Isso nos leva à segunda condição para a ocorrência de isomeria espacial geométrica:
2. Em compostos de cadeia aberta, os ligantes dos átomos de carbono da ligação dupla devem ser diferentes.
Por exemplo, nos casos a seguir temos duas moléculas que possuem apenas um ligante diferente, portanto, a isomeria não ocorre:
H CH2 ─ CH3 H3C CH3
\ / \ /
C ═ C C ═ C
/ \ / \
H H H3C H
2.1. Em compostos de cadeia fechada, pelo menos dois átomos de carbono devem apresentar dois grupos diferentes (não é preciso ter ligação dupla).
Por exemplo, na molécula abaixo não ocorre a isomeria porque há apenas um grupo diferente ligado a um carbono no ciclo, todos os outros ligantes são hidrogênios:
.jpg)
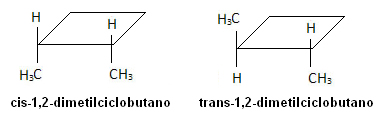
Já na molécula abaixo há a ocorrência de isomeria, sendo que o próprio ciclo serve como plano de referência: