O sódio é um elemento da família dos metais alcalinos (família 1 da Tabela Periódica), cujo símbolo é Na, que vem do latim natrium, nome referente ao minério carbonato de sódio (trona) proveniente do Vale de Natrom, localizado perto de Alexandria e do Cairo. Em português, fala-se “sódio” por causa da soda cáustica (hidróxido de sódio (NaOH)), que foi usada por Humphry Davy em 1807 para produzir esse elemento.
Já o nome “metais alcalinos” vem de Alkali, uma palavra árabe que quer dizer “cinzas”, isso porque o sódio e o potássio, que também pertence a essa família, foram encontrados em cinzas vegetais queimadas.

O sódio metálico é um elemento altamente reativo, que pega fogo espontaneamente (por isso, ele é guardado em recipientes que contêm querosene ou benzeno), reagindo violentamente com a água e queima a pele de quem o segura.

Reação violenta do sódio na água quebra recipiente de vidro*
Esse elemento não é encontrado isolado na natureza, mas somente na forma de seus íons (cátion Na+), formando compostos como o sal de cozinha (NaCℓ). Por isso, ele precisa ser produzido em laboratório.
O primeiro método de produção desse elemento era feito por meio da reação de oxirredução entre o mineral carbonato de sódio mencionado e o carbono:
Na2CO3 + 2 C → 2 Na + 3 CO
No entanto, o método utilizado atualmente se baseia no que foi usado por Humphry Davy, no qual ele realizou a eletrólise ígnea da soda cáustica, ou seja, ele passou uma corrente elétrica pelo hidróxido de sódio fundido. Hoje se faz a eletrolise ígnea do cloreto de sódio misturado – Na2CO3 e CaCℓ2, porque o cloreto de sódio sozinho possui ponto de fusão muito alto, sendo aproximadamente igual a 801 ºC. Já a mistura mencionada possui um ponto de fusão menor, igual a aproximadamente 600 ºC.
A seguir, temos um esquema de como ocorre essa eletrólise do sal de cozinha:
.jpg)
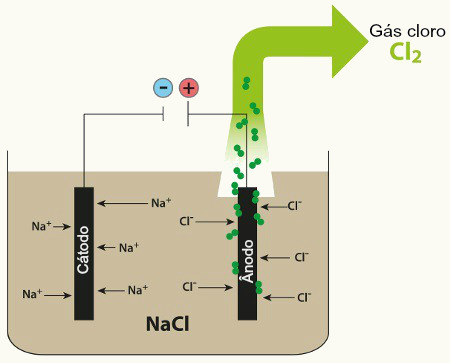
Visto que o sal está fundido, existem no meio os cátions Na+. Assim, quando o gerador (pilha na figura acima) é ligado, ele fornece elétrons para um dos eletrodos, que se torna o cátodo, isto é, o polo negativo. Visto que cargas opostas se atraem, esse polo negativo atrai os cátions Na+ e há a redução desses íons, isto é, eles recebem os elétrons do eletrodo (cátodo) e forma-se o sódio metálico:
Cátodo: Na+(ℓ) + e- → Na(s)
No outro polo ocorre a oxidação do ânion cloreto (Cℓ-), produzindo também o gás cloro:
Cátodo: Na+(ℓ) + e- → Na(s)
Ânodo: 2Cl-(ℓ) → 2 e- + 1Cl2(g)____________
Reação Global: Na+(ℓ) + 2Cl-(ℓ) → Na(s) + 1Cl2(g)
O sódio produzido possui amplas aplicações, sendo que a mais conhecida é na fabricação de lâmpadas a vapor de sódio (amarelas), usadas para iluminação especial de ruas e estradas. Seu maior uso é na produção de peróxido de sódio, Na2O2, e cianeto de sódio, NaCN.

Infelizmente, o Brasil ainda não produz o sódio metálico.
* Crédito editorial da imagem:
Autor: Tavoromann/ Extraída de: Wikimedia Commons