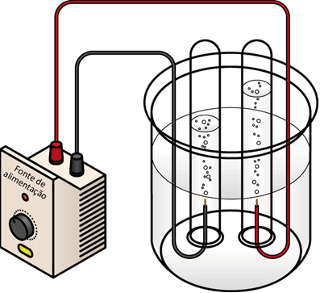
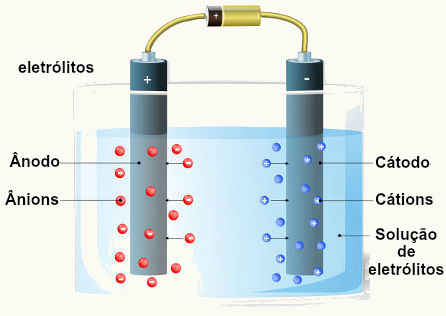
Conforme mostrado no texto Equilíbrio iônico da água, suas moléculas sofrem autoionização e geram os íons hidrônio (H3O+(aq)) e hidroxila (OH-(aq) ):
H2O(l) + H2O(l) ↔ H3O+(aq) + OH-(aq)
A eletrólise da água ocorre quando esse íons descarregam-se nos eletrodos. No entanto, essa autoionização não produz uma quantidade de íons suficiente para conduzir corrente elétrica e permitir que eles descarreguem-se continuamente.
Assim, para conseguir realizar a eletrólise da água, é preciso adicionar algum eletrólito que seja solúvel nela e que gere íons mais reativos que os íons hidrônio (H3O+(aq)) e hidroxila (OH-(aq) ). Isso porque quanto mais reativo (eletropositivo) for um metal, maior será a sua tendência de doar elétrons e menor será a sua tendência de receber elétrons. Assim, o cátion do metal menos reativo descarrega-se primeiro.
Em relação aos ânions, quanto mais eletronegativo é o elemento que os forma, maior é a sua tendência de atrair os elétrons e menor a sua tendência de doá-los. Por isso, o ânion do ametal menos eletronegativo descarrega-se primeiro.
Alguns exemplos de eletrólitos que podem ser usados são o ácido sulfúrico (H2SO4), o hidróxido de sódio (NaOH) e o nitrato de potássio (KNO3).
Sabemos que essas substâncias permitem a descarga dos íons da água porque no texto Eletrólise em meio aquoso foram fornecidas duas tabelas que mostram a ordem descrescente de facilidade de descarga dos cátions e dos ânions.
Segundo a primeira tabela, quando comparamos o cátion hidrônio (H3O+(aq)) com os cátions Na+ e K+ fornecidos, respectivamente, pelo hidróxido de sódio (NaOH) e pelo nitrato de potássio (KNO3), percebemos que esses cátions são mais reativos que o hidrônio e possibilitam, assim, que ele se descarregue primeiro no eletrodo.
Quando analisamos os ânions, vemos que os ânions SO42- (fornecidos pelo ácido sulfúrico) e os NO3- (fornecidos pelo nitrato de potássio) são mais reativos que a hidroxila da água, o que faz com que ela se descarregue primeiro.
Vejamos um exemplo de eletrólise em que o sal nitrato de potássio é dissolvido na água e gera os íons:
Dissociação do sal: 1 KNO3 → 1 K+ + 1 NO3-
Autoionização da água: 8 H2O → 4 H3O+ + 4 OH-
Conforme dito, o K+ é mais reativo que o H3O+. Este possui maior facilidade de descarga, enquanto aquele é mais reativo que o OH-, que, por sua vez, possui maior facilidade de descarga.
Assim, o H3O+ da água sofre redução no eletrodo negativo (cátodo) e produz gás hidrogênio, H2. Já o ânion OH- da água sofre oxidação no eletrodo positivo (ânodo) e produz gás oxigênio, O2:
Semirreação do cátodo: 4 H3O+ + 4 e- → H2O + H2
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
Somando-se todo esse processo, chegamos à equação global:
Dissociação do sal: 1 KNO3 → 1 K+ + 1 NO3-
Ionização da água: 8 H2O → 4 H3O+ + 4 OH-
Semirreação do cátodo: 4 H3O+ + 4 e- → 4 H2O + 2 H2
Semirreação do ânodo: 4 OH- → 2 H2O + 1 O2 + 4 e-
Equação global: 2 H2O → 2 H2 + 1 O2
Não escrevemos o sal na equação global porque ele não participou da reação, seus íons continuaram livres na água na mesma concentração inicial. Ele atuou apenas com o objetivo de ajudar na condução de corrente elétrica e efetivar a eletrólise da água.