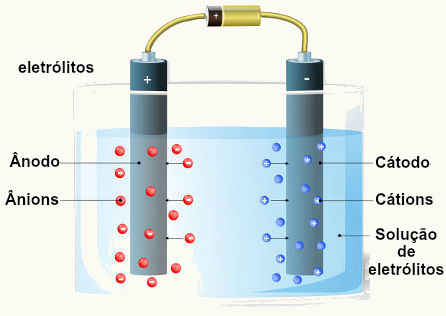
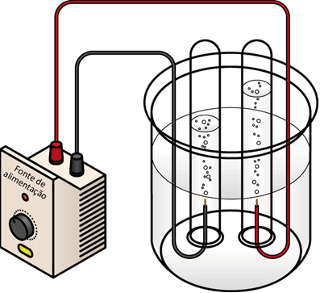
Eletrólise é um processo eletroquímico, no qual ocorrem reações de oxidação e redução quando uma corrente elétrica de uma fonte externa, como uma pilha ou bateria, incide sobre um líquido que contém íons (cátions e ânions).
É possível obter um líquido contendo íons em duas situações:
-
Quando um composto de natureza iônica (ácidos, bases, sais, etc.) é submetido ao fenômeno de fusão (passagem do estado sólido para o líquido);
-
Quando um composto de natureza iônica dissolve-se em água, sofrendo ionização ou dissociação.
Assim, com uma pilha ou uma bateria, para realizar a eletrólise, é necessária uma cuba (contendo os íons), chamada de célula eletrolítica, que apresenta um cátodo e um ânodo.
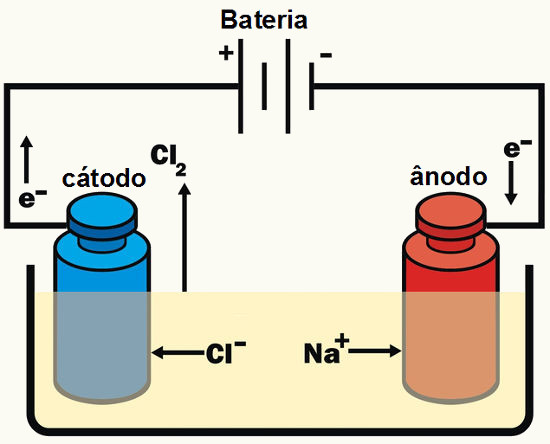
Representação de uma célula eletrolítica
-
Ânodo (polo positivo): local onde ocorre a oxidação;
-
Cátodo (polo negativo): local onde ocorre a redução.
O princípio da eletrólise está baseado no fato de que quando os elétrons da fonte (bateria ou pilha) chegam até a célula eletrolítica (recipiente onde estão os íons), então, o cátion sofrerá redução e os ânions sofrerão oxidação:
-
No cátodo:
![]()
Representação de uma equação catódica
-
No ânodo:
![]()
Representação de uma equação anódica
A eletrólise ígnea é realizada quando um composto de natureza iônica é submetido ao processo de fusão (por meio de aquecimento), dissociando-se e liberando um cátion e um ânion. Se realizarmos a eletrólise ígnea do cloreto de potássio, por exemplo:
.jpg)
Equação representando a dissociação de um composto iônico
Dessa forma, quando a corrente elétrica chega na célula eletrolítica, o cátion sofre a redução no cátodo, e o ânion sofre a oxidação no ânodo.
-
No cátodo:
![]()
Equação de redução com o cátion potássio
Observação: Os cátions de metais sempre formam metais sólidos no cátodo (com exceção do mercúrio).
-
No ânodo:
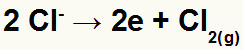
Equação de oxidação com o ânion cloreto
Observação: O estado físico da substância formada no ânodo dependerá do elemento químico.
Eletrólise aquosa ocorre quando temos um eletrólito (por exemplo, um sal, uma base ou um ácido) dissolvido em água, o que favorece a ionização ou dissociação do composto.
Ionizando ou dissociando na água, o composto libera um cátion (Y+) e um ânion (X-). A água fornecerá o cátion hidrônio (H+) e o hidróxido (OH-), porque ela sofre o processo de autoionização.
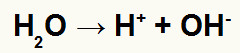
Equação de autoionização da água
Assim, na eletrólise aquosa, temos a presença de dois cátions e de dois ânions, sendo sempre um do composto iônico e o outro da água. Porém, quando a corrente elétrica chegar na solução, apenas um dos cátions e um dos ânions sofrem a descarga elétrica.
Para saber qual íon sofre descarga, devemos conhecer a ordem de descarga seletiva aplicada a eles, a qual estabelece:
-
Com relação aos cátions:
Hidrônio sempre tem prioridade sobre cátions das famílias IA, IIA e IIIA, ou seja, ele sofre a descarga.
Quando o hidrônio sofre descarga e reduz, sempre se transforma na substância simples gás hidrogênio (H2), conforme a equação abaixo:
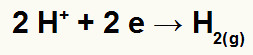
Equação catódica com o hidrônio
-
Com relação aos ânions:
Hidróxido sempre tem prioridade sobre ânions oxigenados e o fluoreto (F-), ou seja, ele sofre a descarga.
Quando o hidróxido sofre descarga e oxida, sempre se transforma na substância simples gás hidrogênio (H2) e na substância composta água, como na equação abaixo:

Equação anódica com o hidróxido
Aproveite para conferir nossa videoaula relacionada ao assunto: