Estequiometria é a relação em massa estabelecida entre a proporção de reagentes para um determinado produto. As questões sobre estequiometria no Enem sempre envolvem cálculos matemáticos de proporcionalidade, que relacionam, além da massa, concentração, volume, massa molar e número de mols. É importante estar atento às unidades de medida dos dados que são fornecidas e a que se pede na resposta final.
Leia também: Temas de Química que mais caem no Enem
Tópicos deste artigo
- 1 - Como a estequiometria é cobrada no Enem?
- 2 - O que é estequiometria?
- 3 - Questões sobre estequiometria no Enem
Como a estequiometria é cobrada no Enem?
As questões sobre estequiometria no Enem normalmente aparecem com um texto informativo sobre algum processo químico industrial, ambiental ou de fenômenos do nosso cotidiano. A pergunta geralmente pede que seja feita uma relação entre as massas das partes desse processo. Pode ser que a questão dê outros dados, como concentração, para que sejam relacionados com a proporção de massa estabelecia pelo cálculo estequiométrico.
É comum vermos questões que inter-relacionam o conteúdo de estequiometria com cálculos de concentração molar, número de mols, volumetria, reações de neutralização, entre outros. Por isso, esteja atento e não confunda as partes. Resolva a questão começando pela verificação do balanceamento da equação química (quando houver), veja quais são as relações que podem ser estabelecidas entre os dados fornecidos pela questão e não perca tempo com o que não é relevante para se chegar à resposta final. Não se esqueça também de verificar se os dados estão coerentes em relação às unidades de medida.
Portanto, para sair bem nas questões de estequiometria, dê aquela revisada nos tópicos de:
-
concentração;
-
número de mols;
-
volume;
-
massa;
-
conversão de unidades.
O que é estequiometria?
A estequiometria é o cálculo que, respeitando as leis ponderais (lei de conservação das massas, proporções definidas e proporções múltiplas), relaciona a quantidade de matéria do produto e do reagente. O que dizem essas leis? E como elas se relacionam com a estequiometria?
-
Lei da conservação das massas: nada se perde, nada se cria, tudo se transforma, ou seja, em uma reação, os elementos químicos podem até se recombinar de forma diferente, mas a quantidade de átomos se mantém antes e depois da reação.
[publicação_omnia]
-
Lei das proporções definidas: independentemente de como ou quanto de um determinado produto é formado, a proporção de reagentes será sempre a mesma. Veja o exemplo a seguir, que envolve a formação de ácido clorídrico (Hcl).
→ 1° caso: Cl2 + H2 → 2HCl
Calculando em massa o que acontece na reação, temos que 2 g de hidrogênio + 71 g de cloro formaram 73 g de ácido clorídrico (considerando uma reação sem perdas). A proporção dos reagentes então fica sendo 2/71.
→ 2° caso: queremos obter 4 mols de HCl: 2Cl2 + 2H2 → 4HCl.
Calculando em massa, temos que 4 g de hidrogênio + 142 g de cloro foram usados para produzir 146 g de ácido clorídrico, e a proporção dos reagentes é de 4/142. Opa! Veja bem essa proporção: a fração 4/142 tem exatamente o mesmo resultado que 2/71 ou ainda 4/146. Sendo simplificada por 2, é igual a 2/71.
Perceba que, apesar de se alterar a quantidade de ácido clorídrico a ser formado, a PROPORÇÃO de reagentes utilizados na reação não se altera.
Veja também: Dicas de química para o Enem
- Lei das proporções múltiplas: para a formação de um determinado composto, há uma proporção definida de massa de reagentes. Se essa proporção for desequilibrada, colocando mais de um determinado reagente do que de outro, “fugindo à receita”, o produto obtido será diferente e com massa e espécie atômica proporcionais ao que foi adicionado nos reagentes. Veja o exemplo:
→ 1° caso: reação de formação de uma molécula de água. Veja:
H2 + 1/2O2 → H2O
2 g de hidrogênio + 16 g de oxigênio → 18 g de água
→ 2° caso: se alterarmos apenas a quantidade de oxigênio da mesma reação, teremos:
H2 + O2 → H2O2
2 g de hidrogênio + 32 g de oxigênio → 36 g de água oxigenada
Perceba que obtivemos um produto diferente, e com massa e espécie atômica proporcionais e correspondentes ao que foi adicionado como reagente.

Questões sobre estequiometria no Enem
Questão 1 – (Enem) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H2SO4) foram derramadas pelo navio Bahamas no litoral do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante. Para isso pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio (CaCO3), na região atingida.
A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas dessas substâncias é:
H2SO4 + CaCO3 → CaSO4 + H2O + CO2
1 tonelada reage com 1 tonelada→ sólido sedimentado e gás
Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse número de caminhões, cada um com carga de 30 toneladas, seria próximo de
A) 100.
B) 200.
C) 300.
D) 400.
E) 500.
Resolução
Alternativa D. Nessa questão, podemos observar pelo balanceamento estequiométrico e pelo comentário seguido da reação que, para 1 tonelada de H2SO4, será necessária 1 tonelada de CaCO3, portanto proporção de 1 para 1. Sendo assim, os cálculos aqui serão em relação à porcentagem de carbonato de cálcio no calcário e à quantidade de caminhões necessária para neutralizar o ácido sulfúrico. Veja:
Se para 10.000 toneladas de calcário → 80% de carbonato de cálcio
x toneladas de calcário → 100% de carbonato de cálcio
x = 12.500 toneladas
1 caminhão é capaz de carregar → 30 toneladas
y caminhões → 12.500 toneladas
y = 417 caminhões
Questão 2 – (Enem) Atualmente, sistemas de purificação de emissões poluidoras estão sendo exigidos por lei em um número cada vez maior de países. O controle das emissões de dióxido de enxofre gasoso, provenientes da queima de carvão que contém enxofre, pode ser feito pela reação desse gás com uma suspensão de hidróxido de cálcio em água, sendo formado um produto não poluidor do ar.
A queima do enxofre e a reação do dióxido de enxofre com o hidróxido de cálcio, bem como as massas de algumas das substâncias envolvidas nessas reações, podem ser assim representadas:
enxofre (32 g) + oxigênio (32 g) → dióxido de enxofre (64 g)
dióxido de enxofre (64 g) + hidróxido de cálcio (74 g) → produto não poluidor
Dessa forma, para absorver todo o dióxido de enxofre produzido pela queima de uma tonelada de carvão (contendo 1% de enxofre), é suficiente a utilização de uma massa de hidróxido de cálcio de aproximadamente:
A) 23 kg.
B) 43 kg.
C) 64 kg.
D) 74 kg.
E) 138 kg.
Resolução
Alternativa A.
Para resolver essa questão, devemos fazer relações da massa usada com a massa dada nas duas reações. Veja:
-
1° passo: descobrir quanto de enxofre tem em 1 tonelada de carvão: sendo 1% de enxofre para cada tonelada, temos 1000 gramas ou 1 kg de enxofre a ser queimado.
-
2° passo: observe na equação dada de queima do enxofre que cada 32 g de enxofre produzem 64 g de dióxido de enxofre. Vamos aqui descobrir quanto de dióxido de enxofre deve ser tratado na queima de 1000 g de enxofre.
Se 32 g de enxofre → 64 g dióxido de enxofre
1000 g de enxofre → x g dióxido de enxofre
x = 20000 g de dióxido de enxofre.
-
3° passo: agora vamos analisar o dióxido de enxofre produzido. Observando a equação da segunda reação (reação de tratamento do dióxido de enxofre com hidróxido de cálcio), podemos estabelecer a seguinte relação:
Para cada 64 g de dióxido de enxofre → 74 g de hidróxido de cálcio
Para 20000 g de dióxido de enxofre → y de hidróxido de cálcio
y = 23125 g de hidróxido de cálcio
Convertendo esse valor para kg: 23,125 kg de hidróxido de cálcio.
Questão 3 – (Enem) O esquema ilustra o processo de obtenção do álcool etílico a partir da cana-de-açúcar.
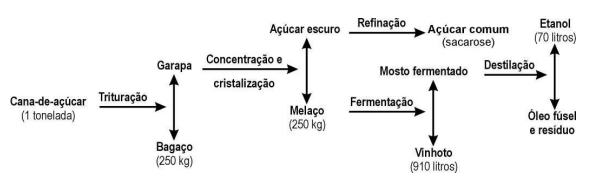
Em 1996, foram produzidos no Brasil 12 bilhões de litros de álcool. A quantidade de cana-de-açúcar, em toneladas, que teve de ser colhida para esse fim foi aproximadamente:
A) 1,7x108.
B) 1,2x109.
C) 1,7x109.
D) 1,2x1010.
E) 7,0x1010
Resolução:
Alternativa A. Repare que, nessa questão, foram apresentados os dados em massa de todo o processo, mas precisamos utilizar apenas dois dados: a massa da cana-de-açúcar e a quantidade em litros de etanol correspondente.
Portanto, se com 1 tonelada é possível produzir 70 litros de etanol, serão necessários x toneladas para produzir 120.108 litros de etanol.
x = 120.108/70
x = 1,7.108