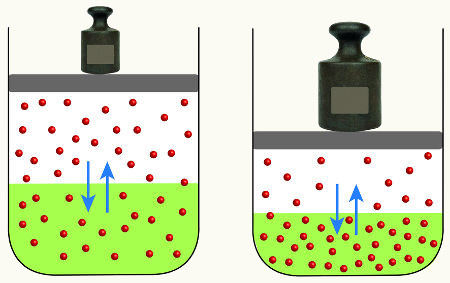
Concentração de soluções é uma medida usada para descrever o quão dissolvido está o soluto em um solvente, ou seja, permite avaliar a quantidade de substância presente em determinada quantidade de solução. Dessa forma, podemos determinar com precisão a proporção do soluto em relação ao solvente, que pode ser expressa em diferentes unidades, como molaridade, fração molar, porcentagem em massa, e volume em volume.
Nesse contexto, esses conceitos são vitais para a preparação de soluções com propriedades específicas, uma vez que o cálculo de reações químicas e a compreensão do impacto de diferentes concentrações nas propriedades físicas e químicas das substâncias fornecem informações essenciais para áreas como farmacologia, química analítica, Biologia e processos industriais.
Leia também: Quais são os tipos de soluções existentes?
Tópicos deste artigo
- 1 - Resumo sobre concentração de soluções
- 2 - O que é a concentração de soluções?
- 3 - Tipos de concentração de soluções
- 4 - → Fração molar
- 5 - Como calcular a concentração de soluções?
- 6 - Exercícios resolvidos sobre concentração de soluções
Resumo sobre concentração de soluções
- Concentração de soluções expressa a quantidade de soluto em relação ao solvente ou à solução total.
- Tipos de concentração: molaridade, porcentagem em massa, fração molar, partes por milhão (ppm), partes por bilhão (ppb), molalidade, concentração comum.
- Cada tipo de concentração tem unidades específicas para expressar a quantidade de soluto em relação ao solvente ou à solução.
- Essa unidade de medida é crucial na preparação de soluções, em cálculos de reações químicas, análises laboratoriais, no controle de qualidade em indústrias e na farmacologia.
- Concentração comum: massa do soluto por volume de solução.
- Molaridade (M): mols de soluto por litro de solução.
- Porcentagem em massa (% m/m): massa do soluto em relação à massa total da solução expressa em porcentagem.
- Fração molar: proporção do número de mols de um componente específico em relação ao total de mols na solução.
- Partes por milhão (ppm), partes por bilhão (ppb) e partes por trilhão (ppt): medidas para concentrações extremamente pequenas.
- Molalidade (m): mols de soluto por quilograma de solvente.
O que é a concentração de soluções?
A concentração de uma solução é uma medida que descreve a quantidade de soluto dissolvido em determinado volume ou massa de solvente. Em outras palavras, é uma forma de expressar a quantidade relativa de uma substância (soluto) em relação à quantidade total da solução.
Por exemplo, a molaridade é uma medida de concentração que representa o número de mols do soluto por litro de solução. Se tivermos 1 mol de sal dissolvido em 1 litro de água, a solução terá uma concentração de 1 mol/L (ou 1 molar, abreviado como 1 M) de sal.
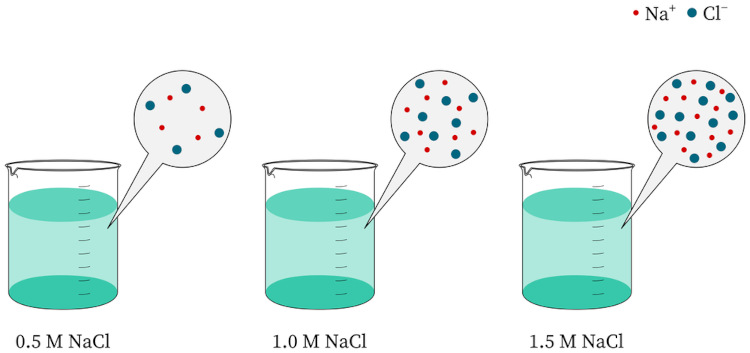
Um mesmo soluto pode ser dissolvido em quantidades diferentes na mesma quantidade de solvente, obtendo-se soluções com diferentes concentrações.
Veja também: Como se calcula a densidade de uma solução?
Tipos de concentração de soluções
Os tipos de concentração de soluções podem ser denominados de acordo com relação entre soluto/solvente e o que se deseja mostrar. Sendo assim, temos:
→ Concentração comum
É a razão entre a massa de soluto e o volume total da solução expressa em gramas por litro (g/L) ou em outras unidades de massa e volume.
\(C=\frac{m_1}{V}\)
Em que:
- C = concentração
- m1 = massa do soluto em gramas
- V = volume em litros
→ Molaridade (M)
Expressa a quantidade de mols de soluto por litro de solução (mol/L). Pode ser obtida por meio da fórmula:
\(M=\frac{n}{V}\)
Em que:
- M = molaridade
- n = nº de mols
- V = volume em litros
→ Porcentagem em massa (% m/m) ou título em massa (T)
Indica a quantidade de soluto em relação à massa total da solução, expressa em porcentagem. Trata-se de uma relação de massa/massa ou volume/volume. Pode ser calculada da seguinte forma:
\(T=\frac{m_1}{m_1+m_2\ }ou\ T=\frac{m_1}{m}\)
Em que:
- m1 (massa do soluto) + m2 (massa do solvente) = m (massa da solução)
Observação: O mesmo raciocínio valeria para volumes.
→ Fração molar
Representa a relação do número de mols de um componente específico (soluto ou solvente) com o número total de mols na solução. É:
\(X=\frac{n_1}{n_1+n_2}\)
Em que:
- X = fração molar de n1 ou n2
- n1 (nº de mols do soluto) + n2 (nº de mols do solvente) = n (nº de mols total da solução)
→ Partes por milhão (ppm), partes por bilhão (ppb) e partes por trilhão (ppt)
Medem a concentração de soluto em relação à quantidade de solvente, considerando quantidades muito pequenas, mas que não deixam de ser relevantes, como é o caso da determinação da concentração de poluentes na atmosfera.
Sendo assim, podemos expressar essas concentrações das seguintes formas:
\(ppm=\frac{xgdesoluto}{{10}^6gdesolvente}\)
\(ppb=\frac{xgdesoluto}{{10}^9gdesolvente}\)
\(ppt=\frac{xgdesoluto}{{10}^{12}gdesolvente}\)
→ Molalidade (m)
Refere-se à quantidade de soluto em mols por quilograma de solvente. Geralmente é representada por mol/kg. Pode ser calculada pela seguinte fórmula:
\(W=\frac{n_1}{m_2}\)
Em que:
- W = molalidade
- n1 = nº de mols do soluto
- m2 = massa do solvente em Kg
Essa medida é especialmente útil em situações nas quais as mudanças de temperatura podem afetar significativamente o volume do solvente, já que a quantidade de soluto em relação à massa do solvente permanece constante.
Como calcular a concentração de soluções?
Como vimos no tópico anterior, existem várias maneiras de expressar a concentração de uma solução, cada uma com suas próprias unidades e métodos de cálculo. Aqui estão alguns exemplos de cálculo:
→ Cálculo de concentração comum
Exemplo:
Se tivermos 20 g de cloreto de sódio dissolvidos em 100 mL de água, a concentração comum é calculada como:
\(C=\frac{20g}{0,1L}\)
\(C=200\ {g}/{L}\)
→ Cálculo de molaridade
Exemplo:
Se dissolvermos 0,2 mol de cloreto de sódio (NaCl) em água suficiente para formar 500 mL de solução, a molaridade seria calculada como:
\(M=\frac{0,2mol}{0,5L}\)
\(M=0,4\ {mols}/{L}\)
→ Cálculo de porcentagem em massa (% m/m) ou título em massa (T)
Exemplo:
Dissolvendo 20 gramas de açúcar em 80 gramas de água, a porcentagem em massa de açúcar na solução é calculada assim:
\(T=\frac{20}{20+80}.100\)
\(T=\frac{20}{100} . 100 = 20\%\)
→ Cálculo de fração molar
Exemplo:
Se tivermos uma solução de etanol (C2H5OH) e água (H2O) em que a fração molar do etanol é 0,4, isso significa que, para cada 5 mols na solução, 2 são de etanol e 3 são de água.
→ Cálculo de partes por milhão (ppm), partes por bilhão (ppb) e partes por trilhão (ppt)
- Exemplo de cálculo de ppm: se tivermos 1 kg de água com 2 mg de um contaminante, a concentração em ppm é calculada desta forma:
\(\left[contaminante\right]=\frac{2mg\ docontaminante}{10^6mg\ de\ água}\)
\(\left[contaminante\right]=2z ppm\)
- Exemplo de cálculo de ppb: se tivermos 1 tonelada (1000 kg) de solo com 5 mg de um metal pesado, a concentração em ppb é calculada assim:
\(\left[metal\ pesado\right]=\frac{5\ mg\ do\ metal\ pesado}{10^9mg\ de\ água}\)
\(\left[metal\ pesado\right]=5\ ppb\)
- Exemplo de cálculo de ppt: se tivermos 1 metro cúbico de ar com 1 µg de um poluente, a concentração em ppt é calculada deste modo:
\(\left[poluente\right]=\frac{1µgdopoluente}{10^{12}µgdear}\)
\(\left[poluente\right]=1ppt\)
→ Cálculo de molalidade (w)
Exemplo:
Se dissolvermos 0,5 mol de sacarose em 500 g de água, a molalidade é calculada assim:
\(W=\frac{0,5mol}{0,5Kg}\)
\(W=1,0\ {mol}/{Kg}\)
Saiba mais: Como ocorre a mistura de soluções com reação química
Exercícios resolvidos sobre concentração de soluções
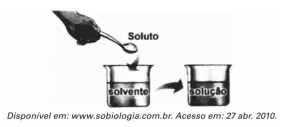
1. (Enem) Ao colocar um pouco de açúcar na água e mexer até a obtenção de uma só fase, prepara-se uma solução. O mesmo acontece ao se adicionar um pouquinho de sal à água e misturar bem. Uma substância capaz de dissolver o soluto é denominada solvente; por exemplo, a água é um solvente para o açúcar, para o sal e para várias outras substâncias. A figura a seguir ilustra essa citação.
Suponha que uma pessoa, para adoçar seu cafezinho, tenha utilizado 3,42 g de sacarose (massa molar igual a 342 g/mol) para uma xícara de 50 mL do líquido. Qual é a concentração final, em mol/L, de sacarose nesse cafezinho?
a) 0,02
b) 0,2
c) 2
d) 200
e) 2000
Gabarito: b
A concentração em mol/L (molaridade) é calculada pela relação M = n/V. Sendo assim, precisamos primeiro descobrir quantos mols há em 3,42 g de sacarose. Para isso, levamos em conta a seguinte relação: \(\ n=\frac{m}{mm}-\rightarrow n=\frac{3,42}{342}=0,01mol\).
Lembre-se de converter o volume dado para litros, logo, 50 mL = 0,05 L. Sendo assim, temos:
\(M=\frac{0,01}{0,05}=0,2\ {mol}{L}\)
2. (Enem) O soro fisiológico é uma solução aquosa de cloreto de sódio (NaCl) comumente utilizada para higienização ocular, nasal, de ferimentos e de lentes de contato. Sua concentração é 0,90 % em massa e densidade igual a 1,00 g/mL. Qual massa de NaCl, em grama, deverá ser adicionada à água para preparar 500 mL desse soro?
a) 0,45
b) 0,90
c) 4,50
d) 9,00
e) 45,00
Gabarito: c)
A densidade nos revela que há 1,00 g para cada 1,00 mL, logo, 500 mL equivale a 500 g. Sendo assim, temos:
\(T=\frac{m_1}{m}\)
Em que:
T = 0,90%
m = 500 g
m = ?
Assim, m = T x m1 ⬜ m = 0,90% x 500 ⬜ m = 4,5 g
Fontes
L. BROWN, T. et al. Concentração de soluções. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 146–149.
SPENCER LIMA, L. Solução (Química). Revista de Ciência Elementar, v. 1, n. 1, p. 9–10, 30 dez. 2013.
SPENCER LIMA, L. Molalidade. Revista de Ciência Elementar, v. 2, n. 1, p. 24927, 30 mar. 2014a.
SPENCER LIMA, L. Concentração Mássica. Revista de Ciência Elementar, v. 2, n. 2, p. 24927, 30 jun. 2014b.
SPENCER LIMA, L. Concentração (Molaridade). Revista de Ciência Elementar, v. 2, n. 2, p. 24927, 30 jun. 2014c.
SPENCER LIMA, L. Fração molar. Revista de Ciência Elementar, v. 2, n. 4, p. 24927, 30 dez. 2014d.