Uma mistura de soluções com reação química é realizada quando adicionamos a um mesmo recipiente duas soluções (cujos solutos apresentam cátions e ânions diferentes). Elas resultam em pelo menos dois novos solutos após a mistura, como no caso a seguir:
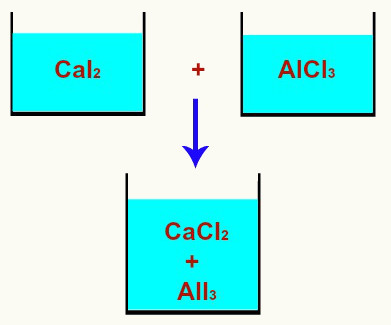
Exemplo de uma mistura de soluções com reação química
Na ilustração acima, a solução 1 contém o soluto iodeto de cálcio (CaI2, cátion cálcio Ca+2 e ânion iodeto I-), e a solução 2 apresenta o cloreto de alumínio (AlCl3, cátion alumínio Al+3 e ânion cloreto Cl-). Quando essas duas soluções são misturadas, por apresentarem íons diferentes, ocorre uma reação química, que pode ser representada pela equação balanceada a seguir:
3CaI2 + 2AlCl3 → 3CaCl2 + 2AlI3
Nessa mistura de soluções com reação química, ocorre a formação dos compostos cloreto de cálcio (CaCl2) e iodeto de alumínio (AlI3).
Para avaliar uma mistura de soluções com reação química
-
1º Passo: Conhecer a equação química que representa o processo;
-
2º Passo: Verificar ou efetuar o balanceamento da equação química que representa a reação para conhecer a proporção estequiométrica entre os participantes dessa equação;
-
3º Passo: Se houver dados suficientes, conhecer o número de mol utilizado de cada um dos solutos nas soluções misturadas;
-
4º Passo: Verificar se o número de mol utilizado está de acordo com a proporção estequiométrica do balanceamento;
-
5º Passo: Determinar o número de mol de cada um dos produtos formados na reação química resultante da mistura;
-
6º Passo: Determinar a concentração de cada um dos produtos na solução resultante, caso seja necessário.
Fórmulas utilizadas nos cálculos de misturas de soluções com reação química
⇒ Determinação do número de mol a partir da massa
Caso seja conhecida a massa do soluto em cada uma das soluções que, misturadas, resultarão em uma reação química, é possível determinar o número de mol de cada soluto pela seguinte fórmula:
n = m1
M1
-
n = número de mol
-
m = massa do soluto fornecida
⇒ Determinação do número de mol a partir do volume e da concentração em mol/L da solução
Caso sejam conhecidos a concentração molar do soluto e o volume da solução de cada uma das soluções misturadas, é possível determinar o número de mol de cada soluto pela seguinte fórmula:
M = n
V
-
M = concentração molar ou em mol/L
-
n = número de mol,
-
V = volume da solução,
Obs.: Essa fórmula pode ser utilizada para determinar a concentração molar de cada um dos produtos tanto na solução final quanto nas soluções iniciais.
Exemplos de cálculos envolvendo mistura de soluções com reação química
1º Exemplo – (UFGD-MS) Um caminhão-tanque tombou e derramou 400 L de ácido sulfúrico, de concentração 6 mol/L, para dentro de uma lagoa. Para amenizar os danos ecológicos, decidiu-se adicionar bicarbonato de sódio à água da lagoa. Calcule a massa mínima de bicarbonato de sódio necessária para reagir com todo o ácido derramado. Dados: NaHCO3 = 84 g/mol
-
Volume da solução 1: 400 L
-
Molaridade da solução 1: 6 mol/L
-
Massa do soluto 2: ?
-
Massa molar do soluto na solução 2: 84 g/mol
Para resolver a questão, devemos realizar os seguintes passos:
1º Passo: Montar e balancear a equação química:
H2SO4 + 2NaHCO3 → 1Na2SO4 + 2H2CO3
ou
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
Obs.: O ácido carbônico (H2CO3) é instável e forma CO2 e H2O.
2º Passo: Proporção da reação.
De acordo com o balanceamento, há 1 mol do ácido sulfúrico (H2SO4) para 2 mol do bicarbonato de sódio nos reagentes e 1 mol de sulfato de sódio (Na2SO4) para 2 mol de ácido carbônico (H2CO3) no produto.
3º Passo: Determinar o número de mol do ácido, a partir dos dados fornecidos, pela expressão a seguir:
M = nH2SO4
V
6 = nH2SO4
400
nH2SO4 = 6.400
nH2SO4 = 2400 mol
4º Passo: Determinar o número de mol de bicarbonato de sódio (NaHCO3).
Para isso, deve-se apenas multiplicar o número de mol do ácido encontrado no terceiro passo por dois, respeitando a estequiometria da equação:
nNaHCO3 = 2. nH2SO4
nNaHCO3 = 2.2400
nNaHCO3 = 4800 mol
5º Passo: Determinar a massa de NaHCO3.
Para isso, são utilizados o número de mol encontrado no quarto passo e a massa molar desse sal na expressão a seguir:
nNaHCO3 = mNaHCO3
MNaHCO3
4800 = mNaHCO3
84
mNaHCO3 = 4800.84
mNaHCO3 = 403200 g
2º Exemplo - (UFBA) 100 mL de uma solução 1 mol/L de Al2(SO4)3 são adicionados a 900 mL de uma solução 1/3 mol/L de Pb(NO3)2. Determine, em gramas, o valor aproximado da massa do PbSO4 formado. Considera-se desprezível a perda de massa do PbSO4 por solubilidade.
-
Volume da solução 1: 100 mL
-
Molaridade da solução 1: 1 mol/L
-
Volume da solução 2: 900 mL
-
Molaridade da solução 2: 1/3 mol/L
Para resolver essa questão, devemos realizar os seguintes passos:
1º Passo: Montar e balancear a equação química:
1Al2(SO4)33 + 3Pb(NO3)2 → 3PbSO4 + 2Al(NO3)3
2º Passo: Proporção da reação.
De acordo com o balanceamento, há 1 mol do sulfato de alumínio [Al2(SO4)3] para 3 mol do nitrato de chumbo II [Pb(NO3)2] nos reagentes e 3 mol de sulfato de chumbo II (PbSO4) para 2 mol de nitrato de alumínio [Al(NO3)3] no produto.
3º Passo: Determinar o número de mol do sulfato de alumínio, a partir dos dados fornecidos, pela expressão a seguir:
M = nAl2(SO4)3
V
1 = nAl2(SO4)3
0,1
nAl2(SO4)3 = 1.0,1
nAl2(SO4)3 = 0,1 mol
4º Passo: Determinar o número de mol do nitrato de chumbo II, a partir dos dados fornecidos, pela expressão a seguir:
M = nPb(NO3)2
V
1 = nPb(NO3)2
3 0,9
3nPb(NO3)2 = 0,9.1
nPb(NO3)2 = 0,9
3
nPb(NO3)2 = 0,3 mol
5º Passo: Verificar se o número de mol encontrado em cada solução obedece à estequiometria da reação.
Há 1 mol do sulfato de alumínio [Al2(SO4)3] para 3 mol do nitrato de chumbo II [Pb(NO3)2]. No terceiro e quarto passo, foram encontrados, respectivamente, 0,1 mol e 0,3 mol, o que significa que os valores obedecem à estequiometria.
6º Passo: Determinar o número de mol do PbSO4.
Para determinar o número de mol do PbSO4, basta utilizar a estequiometria do balanceamento e qualquer número de mol encontrado no terceiro e quarto passo. No balanceamento, há 3 mol para o PbSO4 e 3 mol para o 3Pb(NO3)2, logo, se no quarto passo são encontrados 0,3 mol para o 3 Pb(NO3)2, o PbSO4 também vale 0,3 mol.
7º Passo: Determinar a massa molar do PbSO4.
Para isso, basta multiplicar a quantidade de átomos de cada elemento por sua massa molar e depois somar os resultados:
MPbSO4 = 1.207 + 1.32 + 4.16
MPbSO4 = 207 + 32 + 64
MPbSO4 = 303 g/mol
8º Passo: Determinar a massa do PbSO4.
Para isso, são utilizados o número de mol encontrado no sexto passo e a massa molar encontrada no sétimo passo na fórmula a seguir:
nPbSO4 = mPbSO4
MPbSO4
0,3 = mPbSO4
303
mPbSO4 = 0,3.303
mPbSO4 = 90,9g.
3º Exemplo – (UNA-MG) Um tablete de antiácido contém 0,450 g de hidróxido de magnésio. O volume de solução de HCl a 0,100 M (aproximadamente a concentração de ácido no estômago), que corresponde à neutralização total do ácido pela base, é: Dados: Mg(OH)2 = 58 g/mol
a) 300 mL
b) 78 mL
c) 155 mL
d) 0,35 L
e) 0,1 L
-
Massa do soluto 1: 0,450 g
-
Massa molar do soluto 1: 58 g/mol
-
Volume da solução 2: ?
-
Molaridade da solução 2: 0,1 mol/L
Para resolver essa questão, devemos realizar os seguintes passos:
1º Passo: Montar e balancear a equação química:
Mg(OH)2 + 2HCl → 1MgCl2 + 2H2O
2º Passo: Proporção da reação.
De acordo com o balanceamento, há 1 mol do hidróxido de magnésio (Mg(OH)2) para 2 mol do ácido clorídrico (HCl) no reagente e 1 mol de cloreto de magnésio (MgCl2) para 2 mol de água (H2 O) no produto.
3º Passo: Determinar o número de mol da base (Mg(OH)2), a partir dos dados fornecidos, na expressão a seguir:
nMg(OH)2 = mMg(OH)2
MMg(OH)2
nMg(OH)2 = 0,450
58
nMg(OH)2 = 0,0077 mol
4º Passo: Determinar o número de mol de ácido clorídrico (HCl).
Para isso, deve-se apenas multiplicar o número de mol da base encontrado no terceiro passo por dois, respeitando a estequiometria da equação:
nHCl = 2. nH2SO4
nHCl = 2.0,0077
nHCl = 0,0154 mol
5º Passo: Determinar o volume de HCl.
Para isso, são utilizados o número de mol encontrado no quarto passo e a concentração molar fornecida no enunciado na expressão a seguir:
MHCl = nHCl
V
0,1 = 0,0154
V
0,1V = 0,0154
V = 0,0154
0,1
V = 0,154 L ou 154 mL
4º Exemplo – (PUC-RJ) Na reação de neutralização de 40 mL de solução 1,5 mol.L–1 de hidróxido de sódio com 60 mL de solução 1,0 mol.L–1 de ácido clorídrico, é correto afirmar que a concentração em quantidade de matéria (mol.L–1) de Na+ nos 100 mL resultantes da mistura das soluções é igual a:
a) 0,2
b) 0,4
c) 0,6
d) 0,8
e) 1,2
-
Volume da solução 1: 40 mL ou 0,04 L (dividindo por 1000)
-
Molaridade da solução 1: 1,5 mol/L
-
Volume da solução 2: 60 mL ou 0,06 L (dividindo por 1000)
-
Molaridade da solução 2: 1 mol/L
Para resolver essa questão, devemos realizar os seguintes passos:
1º Passo: Montar e balancear a equação química:
NaOH + HCl → NaCl + 1H2O
2º Passo: Proporção da reação.
De acordo com o balanceamento, há 1 mol do hidróxido de sódio (NaOH) para 1 mol do ácido clorídrico (HCl) nos reagentes e 1 mol de cloreto de sódio (NaCl) para 1 mol de água (H2O) no produto.
3º Passo: Determinar o número de mol do sulfato de alumínio, a partir dos dados fornecidos, na expressão a seguir:
M = nNaOH
V
1,5 = nNaOH
0,04
nNaOH = 1,5.0,04
nNaOH = 0,06 mol
4º Passo: Determinar o número de mol do nitrato de chumbo II, a partir dos dados fornecidos, na expressão a seguir:
M = nHCl
V
1 = nHCl
0,06
nHCl = 1.0,06
nHCl = 0,06 mol
5º Passo: Verificar se o número de mol encontrado em cada solução obedece à estequiometria da reação.
Há 1 mol do NaOH para 1 mol de HCl. No terceiro e quarto passo, foram encontrados 0,06 mol e 0,06 mol, respectivamente, logo, os valores obedecem à estequiometria.
6º Passo: Determinar o número de mol do NaCl.
Para determinar o número de mol do NaCl, basta utilizar a estequiometria do balanceamento e qualquer número de mol encontrado no terceiro e quarto passo. No balanceamento, há 1 mol para o HCl e 1 mol para o NaCl, logo, se no quarto passo forem encontrados 0,06 mol para o HCl, o NaCl também valerá 0,06 mol.
7º Passo: Determinar o volume após a mistura das soluções.
Para isso, basta somar o volume de cada uma das duas soluções que foram misturadas:
V= volume da solução 1 + volume da solução 2
V= 0,004 + 0,06
V=0,1 L
8º Passo: Determinar a concentração molar do NaCl.
Para isso, basta utilizar o número de mol do sexto passo com o volume final da solução encontrado no sétimo passo na expressão a seguir:
MNaCl = nNaCl
V
MNaCl = 0,06
0,1
MNaCl = 0,6 mol/L
9º Passo: Determinar a quantidade de cátions Na+ na solução final.
Para isso, basta multiplicar a concentração molar encontrada no oitavo passo pela quantidade de átomos do Na na fórmula NaCl:
[Na+] = 1.MNaCl
[Na+] = 1. 0,6
[Na+] = 0,6 mol/L