A concentração em quantidade de matéria consiste na relação entre a quantidade de matéria do soluto, expressa em mols, e o volume da solução em litros.
Dessa forma, a concentração em quantidade de matéria indica a quantidade de matéria presente em um litro da solução; por isso sua unidade é mol/L.
Essa grandeza das soluções químicas também é denominada molaridade, concentração molar, ou, ainda, concentração em mol/L. Essa última expressão e a que está sendo usada no título deste texto são as formas recomendadas pela IUPAC (União Internacional da Química Pura e Aplicada) e pelo SI (Sistema Internacional de Unidades).
Matematicamente, temos:

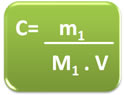
No entanto, em alguns problemas a quantidade de matéria é expressa em gramas e não em mol. Assim, é necessário fazer as devidas conversões ou utilizar a seguinte fórmula matemática deduzida abaixo:
- Sabendo que a fórmula da quantidade de matéria (n1) é dada por:
n1 = m1
M1
Onde:
m1= massa em gramas do soluto;
M1= massa molar do soluto em gramas por mol (g/mol).
- Substituindo n1 na fórmula da concentração em mol/L, temos:
C = n1
V
Vejamos um exemplo que pode ser resolvido trabalhando com a concentração em mol/L:
“Qual é a concentração em quantidade de matéria por volume de uma solução de cloreto de potássio que apresenta 18,5 g de KCl em 250 mL de solução?”
Primeiramente, para resolver esse problema, é necessário transformar o volume da solução de mililitros para litros:
1 L-----1000 mL
V ----- 250 mL
V = 0,25 L
Visto que não foi dada a quantidade de matéria em mols e sim em gramas, iremos usar a segunda expressão matemática mencionada no texto e substituir nela esses valores. A massa molar do KCl é conseguida olhando-se as massas atômicas de cada elemento numa tabela periódica e somando-se os seus valores:
M1(KCl) = 39,1 + 35, 5 = 74,6 g/mol
C = __m1___
M1 . V
C = ___18,5 g_________
74,6 g/mol . 0,25 L
C = 1,0 mol/L
Aproveite para conferir nossas videoaulas relacionadas ao assunto: