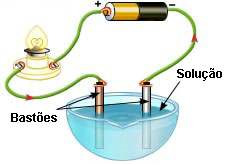
Digamos que a solução em questão seja de água e sal. Se colocarmos os bastões nessa solução, observaremos que a lâmpada acenderá. No entanto, se mudarmos a solução para uma de água e açúcar, a lâmpada permanecerá desligada.
Isso nos mostra que é possível diferenciar as soluções de acordo com a sua condutividade elétrica:
1. Solução iônica ou eletrolítica: esse tipo de solução conduz eletricidade, em razão da presença de íons (átomos ou grupos de átomos de elementos químicos com carga elétrica). Esses íons com carga negativa (ânion) e positiva (cátions) fecham o circuito elétrico conduzindo a corrente.
A solução iônica ou eletrolítica pode ser obtida de duas formas:
1.1. Ionização: é a formação de íons em virtude do rompimento de ligações covalentes. Por exemplo, se diluirmos ácido clorídrico (HCl), que é um composto formado por moléculas, em água; ocorrerá a quebra dessas moléculas pela água, originando íons. As equações químicas abaixo demonstram como isso ocorre:
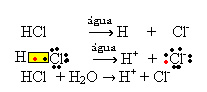
1.2. Dissociação iônica: no caso da primeira solução citada no exemplo acima, temos a dissolução do sal de cozinha ((NaCl – cloreto de sódio), que é um composto iônico, isto é, que já era formado por íons. A água apenas separou os íons já existentes no aglomerado iônico:
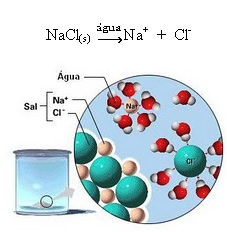
Observe na figura acima que o sal (NaCl) estava na forma de retículo cristalino, porém, por ser uma substância polar, seu polo negativo, que é o Cl-, é atraído pelo polo positivo da água, que é o H+. E o polo positivo do sal, que é o Na+, é atraído pelo OH-, que é o polo negativo da água. Assim, os íons que antes estavam ligados pela ligação iônica são separados.
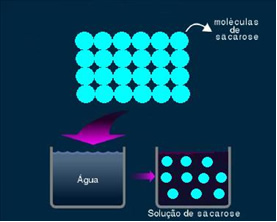
2. Solução molecular ou não eletrolítica: esse tipo de solução não conduz eletricidade. É o segundo caso que citamos, da solução de água e açúcar. O açúcar (sacarose – C12H22O11) é um composto molecular que sofre dissociação sem formar íons. As suas moléculas, que antes estavam agrupadas, são apenas separadas. Assim, por não conter carga, essa solução não conduz corrente elétrica.
Videoaula relacionada: