Existem três critérios de classificação das bases inorgânicas, que são: número de íons hidróxido, grau de dissociação e solubilidade. Veja cada um deles:
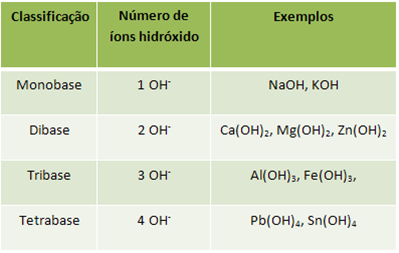
- Classificação quanto ao número de íons hidróxido (OH-):
Segundo o conceito visto no texto “Bases”, as bases são substâncias que em meio aquoso se dissociam liberando como único ânion o íon hidróxido (OH-). Algumas bases produzem, então, apenas um íon desses, enquanto que outras podem ter mais íons OH- dissociados.
Com isso em mente, temos a seguinte classificação:
- Classificação quanto ao grau de dissociação (α):
Essa classificação é a mais importante, pois mede a força da base. Representa a porcentagem de íons hidróxido da base que se dissociam em água. A fórmula utilizada para calcular o grau de dissociação α das bases é:
![]()
Geralmente, a temperatura de 18 ºC, se o valor der maior que 50% corresponde a uma base forte, podendo chegar a aproximadamente 100%, como mostra o caso do hidróxido de sódio (NaOH), cujo grau de dissociação é de 95%. Já as bases fracas possuem o grau de dissociação igual ou menor que 5%.
- Bases fortes: bases de metais alcalinos (NaOH, LiOH, KOH, RbOH, CsOH) e de alguns metais alcalinoterrosos (Ca(OH)2, Sr(OH)2, Ba(OH)2);
- Bases fracas: Bases de metais de transição, dos metais das famílias 13, 14 e 15 da tabela periódica, o hidróxido de magnésio (Mg(OH)2) e o hidróxido de amônio (NH4OH).
- Classificação quanto à solubilidade:
As bases podem ser classificadas como solúveis, pouco solúveis ou praticamente insolúveis em água. Essa classificação é importante porque a solubilidade está diretamente relacionada com o grau de dissociação delas, que, como vimos, representa sua força. Quando mais dissolvida a base, maior será o grau de dissociação, com exceção apenas do hidróxido de amônio (NH4OH), que embora se dissolva facilmente em água, possui um grau de dissociação muito pequeno.
O hidróxido de amônio se dissolve tão bem no meio aquoso que muitos cientistas consideram que ele não existe, mas que na verdade seria o gás amônia (NH3(g)) dissolvido em água. Mas, a grande maioria dos autores e instituições educacionais de renome ainda o considera como a base citada.
Temos a seguinte classificação:

- Bases solúveis: Os metais alcalinos são os que melhor se solubilizam (por isso, são bases fortes). Sendo que entre os metais dessa família que formam as monobases, a solubilidade cresce conforme o período na família aumenta, como é mostrado a seguir:
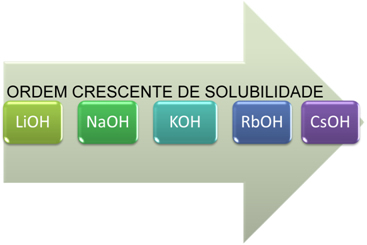
- Bases solúveis: Os metais alcalinoterrosos são menos solúveis em água do que os metais alcalinos, com exceção do Mg(OH)2 e do Be(OH)2 que são praticamente insolúveis. Sua ordem de solubilidade também aumenta com o aumento dos períodos ao longo da família.
- Bases praticamente insolúveis: São os hidróxidos dos demais metais, o Mg(OH)2 e o Be(OH)2.
Aproveite para conferir nossas videoaulas sobre o assunto: