Uma reação de dupla troca entre uma base (ZOH) e um sal (WX) ocorre sempre que estes dois tipos de substâncias inorgânicas são misturados em um mesmo recipiente, formando um novo sal e uma nova base.
Durante este tipo de reação de dupla troca o cátion da base (Z) interage com o ânion do sal (X), enquanto o cátion do sal interage com o ânion hidróxido (OH) da base, como podemos observar na equação geral abaixo:
ZOH + WX → ZX +WOH
Um fato interessante é que quando realizamos uma reação de dupla troca entre sal e base pode acontecer de observamos no meio reacional (recipiente) algum ou todos os itens abaixo:
-
Formação de um precipitado (um sólido, que se deposita no fundo do recipiente)
-
Formação de bolhas
-
Mudança de coloração da solução
1- Dupla troca entre sal e base com formação de um precipitado
A formação de um precipitado ocorre sempre que um ou mais produtos formados em uma reação é pouco solúvel ou praticamente insolúvel em água, seja ele uma base ou um sal.
Abaixo temos a classificação utilizada quanto a solubilidade das bases:
-
Base pouco solúvel: aquelas que possuem metal alcalinoterroso (elemento da família IIA da tabela periódica)
-
Base praticamente insolúvel: aquelas que não possuem metal alcalino (família IA da tabela periódica) ou é o hidróxido de amônio (NH4OH)
Já os sais, de uma forma geral podem ser classificados apenas em solúveis ou praticamente insolúveis, classificação a qual pode ser determinada de forma bastante simples através da tabela de solubilidade dos sais abaixo:
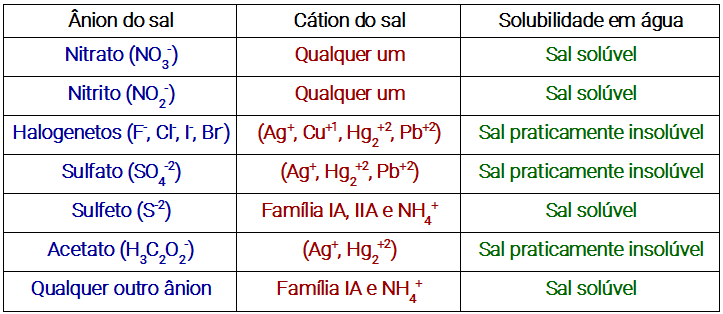
Tabela que especifica quando um sal é solúvel ou praticamente insolúvel
Agora, vamos acompanhar exemplos de reações d dupla troca entre sal e base nas quais temos a formação de um ou mais produtos pouco solúveis ou praticamente insolúveis:
Exemplo 1: Reação entre o carbonato de bário (BaCO3) e o hidróxido de sódio (NaOH)
Nesta reação o Carbonato do sal se une ao sódio da base formando o sal carbonato de sódio (Na2CO3), já o bário do sal se une ao hidróxido da base formando o hidróxido de bário, como podemos observar na equação balanceada abaixo:
BaCO3 + NaOH → Ba(OH)2 + Na2 CO3
Como o bário é um metal alcalinoterroso, logo o hidróxido de bário é uma base pouco solúvel. Logo, observaremos a formação de um precipitado no fundo do recipiente.
OBS.: O sal formado, de acordo com a tabela de solubilidade, é solúvel porque temos o ânion carbonato com um metal alcalino.
BaCO3 + 2 NaOH → Ba(OH)2(s) + Na2 CO3(aq)
Exemplo 2: Reação entre o sulfato de ferro II (FeSO4) e o hidróxido de potássio (KOH)
Nesta reação o sulfato (SO4) do sal se une ao potássio da base formando o sal sulfato de potássio (K2 SO4), já o ferro II do sal se une ao hidróxido da base formando o hidróxido de ferro II, como podemos observar na equação balanceada abaixo:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4
Como o bário é um metal alcalinoterroso, logo o hidróxido de bário é uma base pouco solúvel. Logo, observaremos a formação de um precipitado no fundo do recipiente.
OBS.: O sal formado, de acordo com a tabela de solubilidade, é solúvel porque temos o ânion sulfato com um metal alcalino.
FeSO4 + 2KOH → Fe(OH)2(s) + K2SO4(aq)
Exemplo 3: Reação entre o fosfato de lítio (Li3PO4) e o hidróxido de ouro III [Au(OH)3]
Nesta reação o fosfato (PO4) do sal se une ao ouro III da base formando o sal fosfato de ouro III (AuPO4), já o lítio do sal se une ao hidróxido da base formando o hidróxido de lítio, como podemos observar na equação balanceada abaixo:
Li3PO4 + Au(OH)3 → 3LiOH + AuPO4
O lítio é um metal alcalino, logo o hidróxido de lítio formado é uma base solúvel. O sal formado (fosfato de ouro III), de acordo com a tabela de solubilidade, é praticamente insolúvel porque o ânion fosfato está associado a metal diferente de alcalino, por isso observaremos a formação de um precipitado no fundo do recipiente.
Li3PO4 + Au(OH)3 → 3LiOH(aq) + AuPO4(s)
2- Formação de bolhas

Borbulhamento resultante de uma reação com formação de gás
Temos a formação de bolhas em um meio reacional quando um dos produtos formados na reação é um gás. No caso das reações de dupla troca entre sal e base, temos a formação de bolhas apenas se o hidróxido de amônio (NH4OH) for formado, como na equação genérica abaixo
NH4X + YOH → NH4OH + YX
O hidróxido de amônio é uma base bastante solúvel em água e por ser uma base é sólido. Porém, além destas características, trata-se de uma base instável, ou seja, se converte naturalmente em outras substancias. Ele se transforma espontaneamente em água e amônia (que é um gás):
NH4OH → NH3(g) + H2O
Assim, visualizamos a formação de bolhas no recipiente. Agora acompanhe um exemplo deste tipo de situação:
Exemplo: Dupla troca entre o hidróxido de potássio (KOH) e o cianeto de amônio (NH4CN)
KOH + NH4CN → NH4OH(aq) + KCN(aq)
Após a decomposição do hidróxido de amônio temos a seguinte equação final:
KOH + NH4CN → NH3(g) + H2O(l) + KCN(aq)
3- Mudança de coloração da solução
Quando realizamos uma reação de dupla troca entre sal e base pode acontecer da formação de um sal solúvel que possua uma cor diferente do sal utilizado no reagente. Assim, o novo sal ao se dissolver na água forma uma solução de cor diferente. Como podemos observar na imagem abaixo

Mistura de soluções resultando em mudança de cor
Nela temos uma solução básica incolor e uma solução salina de cor, porém quando são misturadas ocorre a reação de dupla troca entre sal e base, mudança.