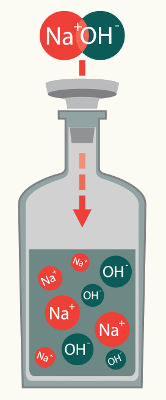
Para saber realizar a montagem da fórmula de uma base, é necessário conhecer a definição de uma base inorgânica. Base inorgânica é toda substância que, quando adicionada à água, libera um cátion qualquer e um ânion hidróxido OH-.
A partir dessa definição, podemos perceber que a fórmula de uma base é composta pelo grupo aniônico (OH-), ligado diretamente à sigla de um elemento de natureza metálica (Y). Isso significa que a fórmula geral de uma base apresenta o seguinte padrão:
YOH
Vale ressaltar que a montagem da fórmula das bases depende basicamente de dois fatores:
-
Carga do cátion presente na base;
Observe esses fatores nos seguintes exemplos:
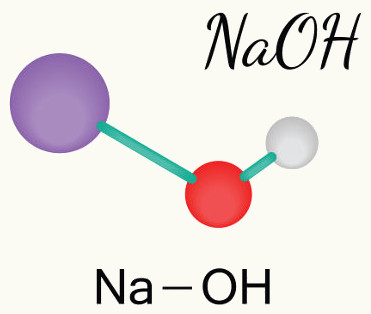
1º Exemplo: Hidróxido de sódio
O hidróxido de sódio é uma base composta por um elemento químico da família dos metais alcalinos, a qual apresenta NOX fixo (sempre igual a +1), por isso, a quantidade de hidroxilas nessa base é igual a 1. Assim, a fórmula do hidróxido de sódio é:
NaOH
2º Exemplo: Hidróxido de magnésio
O hidróxido de magnésio é uma base composta por um elemento químico da família dos metais alcalinoterrosos, a qual apresenta NOX fixo (sempre igual a +2), por isso, a quantidade de hidroxilas nessa base é igual a 2. Assim, a fórmula do hidróxido de magnésio é:
Mg(OH)2
3º Exemplo: Hidróxido de zinco
O elemento zinco (Zn) tem NOX fixo (sempre igual a +2), por isso, a quantidade de hidroxilas nessa base é igual a 2. Assim, a fórmula do hidróxido de zinco é:
Zn(OH)2
4º Exemplo: Hidróxido de prata
O elemento prata (Ag) apresenta NOX fixo (sempre igual a +1). Por essa razão, a quantidade de hidroxilas nessa base é igual a 1. Assim, a fórmula do hidróxido de prata é:
AgOH
5º Exemplo: Hidróxido de alumínio
O hidróxido de alumínio é uma base composta por um elemento químico da família do boro, a qual apresenta NOX fixo (sempre igual a +3). Em razão disso, a quantidade de hidroxilas nessa base é igual a 3. Assim, a fórmula do hidróxido de alumínio é:
Al(OH)3
Atenção: Quando a base for formada por elementos que são diferentes da prata, do zinco, ou não pertençam às famílias IA, IIA e IIIA, a quantidade de hidroxilas aparecerá no nome da base (em algarismo romano), como podemos observar nos seguintes exemplos:
1º Exemplo: Hidróxido de ouro I
Nesse caso, temos uma base formada por um elemento da família IB, o que faz com que o número de hidroxilas de sua fórmula seja determinado pela carga desse elemento especificada no nome. Assim, a quantidade de hidroxilas nessa base é igual a 1, resultando na fórmula a seguir:
AuOH
2º Exemplo: Hidróxido de titânio II
Essa é uma base formada por um elemento da família IVB, o que faz com o que o número de hidroxilas de sua fórmula seja determinado pela carga desse elemento especificada no nome. Assim, a quantidade de hidroxilas nessa base é igual a 2, resultando na fórmula:
Ti(OH)2
3º Exemplo: Hidróxido de crômio III
Essa base é formada por um elemento da família VIB, o que define o número de hidroxilas de sua fórmula pela carga desse elemento especificada no nome. Portanto, a quantidade de hidroxilas nessa base é igual a 3, resultando na fórmula:
Cr(OH)3
4º Exemplo: Hidróxido de chumbo IV
Essa base é formada por um elemento da família IVA, o que faz com que o número de hidroxilas de sua fórmula seja determinado pela carga desse elemento especificada no nome. Assim, a quantidade de hidroxilas nessa base é igual a 4, resultando na fórmula:
Pb(OH)4
5º Exemplo: Hidróxido de antimônio V
Essa base é formada por um elemento da família VA, cujo número de hidroxilas de sua fórmula é determinado pela carga desse elemento especificada no nome. Portanto, a quantidade de hidroxilas nessa base é igual a 5, resultando na fórmula:
Sb(OH)5
Videoaula relacionada: