Como o próprio nome indica, uma equação de dissociação representa o fenômeno físico da dissociação, que ocorre com toda e qualquer base inorgânica quando misturada à água. Como a base é uma substancia iônica, sempre que ela é adicionada à água, ocorre a separação entre os cátions (metal) e os ânions (hidroxila) que esse composto inorgânico apresenta. De uma forma geral, a dissociação de uma base é sempre representada da seguinte forma:
YOH → Y+ + OH-1
-
base (YOH) no reagente;
-
seta;
-
à direita da seta, teremos sempre um cátion e o OH-1.
Analisando a forma geral da dissociação de uma base, podemos concluir que sempre o metal (Y) da base dará origem ao cátion (Y+) e a hidroxila dará origem ao ânion hidróxido (OH-). Vale salientar que a carga do cátion liberado em uma dissociação será sempre igual ao índice (região direita inferior) presente na hidroxila.
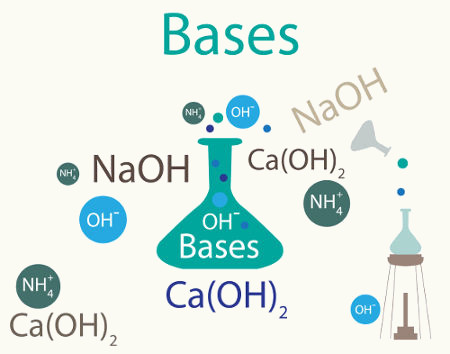
Exemplos de equações de dissociação de bases:
-
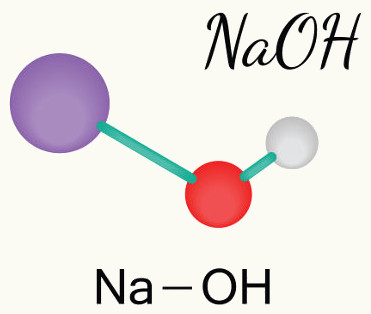
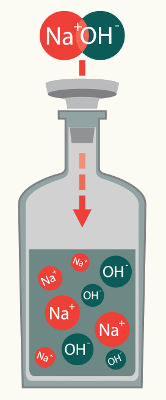
NaOH
NaOH → Na+ + 1 OH-1
Na equação de dissociação do hidróxido de sódio NaOH, ocorre a liberação do cátion (Na+) e do ânion OH-. A carga +1 do cátion deve-se ao índice 1 na região direita inferior do grupo hidroxila (OH), motivo que também justifica o coeficiente 1 posicionado à esquerda do ânion hidróxido (OH-).
-
Ca(OH)2
Ca(OH)2 → Ca+2 + 2 OH-1
Na equação de dissociação do hidróxido de cálcio [Ca(OH)2], ocorre a liberação do cátion (Ca+2) e do ânion OH-. A carga +2 do cátion deve-se ao índice 2 na região direita inferior do grupo hidroxila (OH), motivo que também justifica o coeficiente 2 posicionado à esquerda do ânion hidróxido (OH-).
-
Cr(OH)3
Cr(OH)3 → Cr+3 + 3 OH-1
Na equação de dissociação do hidróxido de crômio III [Cr(OH)3], ocorre a liberação do cátion (Cr+3) e do ânion OH-. A carga +3 do cátion deve-se ao índice 3 na região direita inferior do grupo hidroxila (OH), motivo que também justifica o coeficiente 3 posicionado à esquerda do ânion hidróxido (OH-).
-
Ti(OH)4
Ti(OH)4 → Ti+4 + 4 OH-1
Na equação de dissociação do hidróxido de titânio IV [Ti(OH)4], ocorre a liberação do cátion (Ti+4) e do ânion OH-. A carga +4 do cátion deve-se ao índice 4 na região direita inferior do grupo hidroxila (OH), motivo que também justifica o coeficiente 4 posicionado à esquerda do ânion hidróxido (OH-).
-
Sb(OH)5
Sb(OH)5 → Sb+5 + 5 OH-1
Na equação de dissociação do hidróxido de antimônio V [Sb(OH)5], ocorre a liberação do cátion (Sb+5) e do ânion OH-. A carga +5 do cátion deve-se ao índice 5 na região direita inferior do grupo hidroxila (OH), motivo que também justifica o coeficiente 5 posicionado à esquerda do ânion hidróxido (OH-).
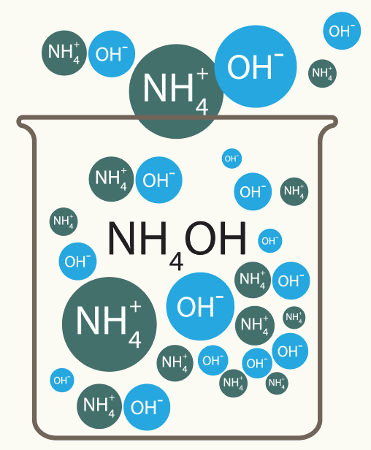
Observação: Vale ressaltar que existe uma base inorgânica que não apresenta metal na sua composição, mas esse fato não muda a construção da sua equação de dissociação. A base em questão é o hidróxido de amônio (NH4OH) e sua equação é:
NH4OH → NH4+ + OH-1