A Termodinâmica é área da Termologia que estuda as mudanças nas variáveis de estado de um gás (pressão, temperatura e volume) relacionando-as com o ganho, perda ou ausência de calor. A Termodinâmica apresenta duas leis principais. A primeira relaciona a energia interna de um gás com o calor recebido ou cedido por ele e o trabalho que ele realiza devido a esse calor. A segunda lei está relacionada com a eficiência de uma máquina, ou seja, sua capacidade de transformar o calor recebido em trabalho. Porém, como sempre ocorrem perdas de energia para o ambiente, não existe uma máquina perfeita.
Leia também: Calorimetria — a área da Termologia que estuda o calor
Tópicos deste artigo
- 1 - Resumo sobre Termodinâmica
- 2 - O que é Termodinâmica?
- 3 - Leis da Termodinâmica
- 4 - Conceitos da Termodinâmica
- 5 - Fórmulas da Termodinâmica
- 6 - Aplicações da Termodinâmica
- 7 - Exercícios resolvidos sobre Termodinâmica
Resumo sobre Termodinâmica
-
A Termodinâmica estuda as transformações gasosas devido ao ganho, perda ou ausência de calor em um sistema.
-
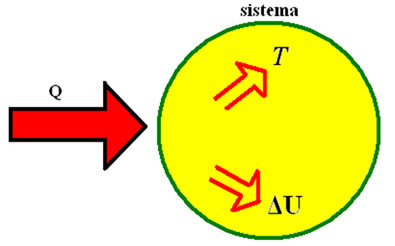
A primeira lei da Termodinâmica determina que a energia interna de um sistema está relacionada com o calor ganho e com o trabalho executado por ele.
-
A segunda lei da Termodinâmica determina que não existe uma máquina térmica perfeita, pois sempre haverá energia transferida para fora do sistema.
-
Além da primeira e da segunda lei, a Termodinâmica possui duas outras leis não oficiais: lei zero da Termodinâmica e terceira lei da Termodinâmica.
-
Os conceitos básicos da Termodinâmica são as notações próprias de seus componentes, como sistema, meio externo, variáveis de estado e transformações gasosas.
-
A Termodinâmica é amplamente aplicada no cotidiano. Todo motor de combustão interna é um exemplo da aplicação das leis da Termodinâmica.
O que é Termodinâmica?
A Termodinâmica é a área da Física que tem como principal objeto de estudo a forma como o calor pode afetar as variáveis de estado de um sistema. O calor é energia térmica em movimento, ou seja, o calor só existe quando há diferença de temperatura. No momento em que todos os componentes de um sistema atingem a mesma temperatura, o calor torna-se nulo.
Leis da Termodinâmica
A Termodinâmica apresenta duas leis ou princípios principais.
-
Primeira lei da Termodinâmica: esse princípio determina que a energia interna de um sistema equivale à diferença entre o calor recebido ou cedido pelo gás e o trabalho que ele executa. Quando um gás ganha calor, sua temperatura aumenta, aumentando também sua energia interna, devido ao aumento da sua temperatura. Como a temperatura aumenta, o gás tem seu volume aumentado também e consequentemente realiza um trabalho de deslocar as paredes do recipiente em que se encontra.
-
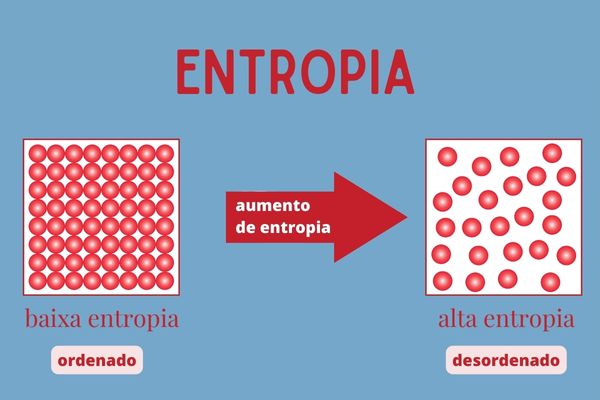
Segunda lei da Termodinâmica: determina que o calor sempre flui de um corpo ou ambiente de temperatura mais alta para outro onde a temperatura está mais baixa, até que todos os componentes do sistema estejam com a mesma temperatura. Com isso, ocorre o aumento da entropia do sistema, sendo que entropia é a medida de caos ou desordem dos seus componentes.
Porém, além dessas duas leis, existem duas leis não oficiais da Termodinâmica:
-
Lei zero da Termodinâmica: afirma que se caso dois ou mais corpos e o meio estejam na mesma temperatura, o sistema todo estará em equilíbrio, logo não há calor, independentemente de qual seja a temperatura, elevada ou baixa.
-
Terceira lei da Termodinâmica: afirma que é impossível um sistema atingir o zero absoluto (zero kelvin ou -273 °C). Nessa temperatura, todas as partículas que compõem o gás estão em repouso, consequentemente a entropia chega muito próximo de ser nula.
Importante: Uma observação relevante é que os conceitos de frio e quente cientificamente não existem, já que tratam de uma sensação térmica e podem variar de um organismo para o outro. Sendo assim, o quanto um corpo está quente ou frio não pode ser mensurado. O que é possível de medir é a presença ou ausência de calor, ou a medida da temperatura.
Veja também: Três erros cometidos em Termologia
Conceitos da Termodinâmica
A Termodinâmica apresenta alguns conceitos próprios. Os principais estão listados a seguir.
-
Sistema: corpo, conjunto de corpos e meio que estão em análise ou objeto de estudo do problema.
-
Meio exterior: o que não faz parte do sistema.
-
Estado: condição na qual o sistema se encontra em relação à sua temperatura, espaço de ocupação e pressão nas paredes do recipiente que ocupa.
-
Variáveis de estado: são as características do gás que podem estar sujeitas a variação devido ao ganho, perda ou ausência de calor, que no caso são a pressão, temperatura e volume.
-
Transformações gasosas: são as mudanças sofridas pelas variáveis de estado do gás que estão relacionadas ao calor. Quando a temperatura permanece constante, é transformação isotérmica; quando a pressão é constante, é transformação isobárica; quando o volume é constante, é transformação isocórica ou isovolumétrica; e quando não ocorrem trocas de calor do gás com o meio externo e a temperatura sofre variação, é transformação adiabática.
-
Máquinas térmicas: considerando que máquina é qualquer dispositivo que seja capaz de transferir ou transformar energia, uma máquina térmica é aquela em que o calor é convertido em outro tipo de energia para executar uma tarefa.
Fórmulas da Termodinâmica
→ Primeira lei da Termodinâmica
A primeira lei da Termodinâmica diz que a variação da energia interna de um sistema (símbolo ΔE, medida em joule J) equivale à diferença entre o calor (símbolo Q, medido em joule J) recebido ou cedido ao gás e o trabalho (símbolo W, medido em joule J) realizado por ele.
\(∆E=Q-W\)
Caso o gás receba calor, Q será positivo. Caso ele perca, será negativo. Se o gás expandir, o trabalho W será positivo. Se ele contrair, o trabalho será negativo.
A variação de energia está relacionada à temperatura do gás. Logo, nas transformações isotérmicas, onde a temperatura é constante, ela é nula, e a equação é reescrita, sendo o calor igual ao trabalho.
Q = W
Nas transformações isovolumétricas, o volume é constante, e o trabalho está relacionado à variação do volume. Logo, o trabalho será nulo, e a energia interna será igual ao calor.
\(∆E\) = Q
Nas transformações adiabáticas, em que não há trocas de calor entre o gás e o meio, Q será nulo. Sendo assim, a energia interna é igual ao trabalho negativo, já que se o gás se expandir, sua energia interna diminuirá.
\(∆E\) = -W
-
Exemplo:
Um gás está contido em um recipiente cilíndrico que está lacrado por um êmbolo móvel. Após receber 5,4 KJ de calor, ele se expande e empurra o êmbolo realizando um trabalho de 3900 J. Qual foi a variação da energia interna do gás?
Resolução:
Extraindo os dados do problema:
Q = 5,4 KJ (positivo, já que recebeu calor)
W = 3900 J (positivo, porque o gás se expandiu)
\(∆E\) = ?
É necessário converter KJ em J. Para isso, multiplica-se por 1000, porque 1 KJ vale 1000 J.
Q = 5,4 KJ·1000 = 5400 J
\(∆E=Q-W\)
\(∆E=5400-3900\)
\(∆E=1500\ J\)
→ Segunda lei da Termodinâmica
A segunda lei da Termodinâmica está relacionada com o rendimento (símbolo η) de uma máquina térmica. O rendimento pode ser a razão entre o trabalho W e o módulo do calor recebido pela fonte de calor QC.
\(η=\frac{W}{Q_c }\)
Em termos de porcentagem, basta multiplicar o resultado por 100%.
\(η=\frac{W}{Q_c\cdot100%}\)
O calor provido pela fonte QC equivale à soma do trabalho com o calor cedido para a fonte fria QF, que no caso é o ambiente.
\(Q_C=W+Q_F\)
Lembrando que o rendimento é a diferença entre 1 e a razão entre a potência útil PU e a potência total PT de uma máquina.
\(η=1-\frac{P_U}{P_T }\)
Em termos da temperatura da fonte de calor TC e da fonte fria TF (que recebe o calor da máquina), o rendimento pode ser escrito como na equação a seguir.
\(η=1-\frac{T_F}{T_C }\)
-
Exemplo
Determinado gás, dentro de um motor, recebeu 40000 J de calor e perdeu 16000 para uma fonte fria. Qual é a porcentagem do rendimento deste motor?
Resolução:
Extraindo os dados:
QC = 40000 J
QF = 16000 J
η = ?
Para calcular o rendimento, é necessário obter o trabalho primeiro.
\(Q_C=W+Q_F\)
\(40000=W+16000\)
Invertendo os lados da equação:
\(W+16000=40000\)
\(W=40000-16000=24000\ J\)
\(η=\frac{W}{Q_c}\cdot100\%\)
\(η=\frac{24000}{40000}\cdot100\%=0,6\cdot100\%=60\%\)
\(η=60\%\)
Aplicações da Termodinâmica
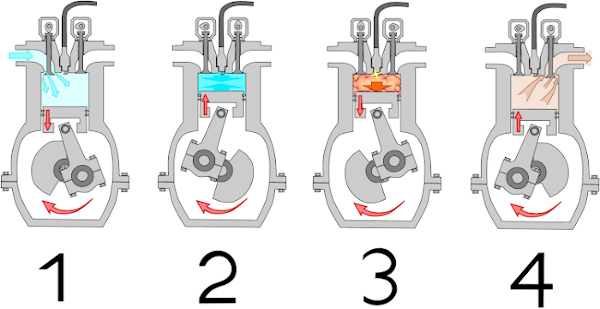
A Termodinâmica está envolvida amplamente no cotidiano humano. Um exemplo disso é o funcionamento do motor de combustão de um automóvel. O combustível presente no tanque entra em combustão devido a uma faísca provida pela injeção eletrônica. Essa combustão faz com que os pistões que compõem o motor se expandam, fazendo, com isso, o carro funcionar. Após o calor ser transmitido para o meio, o processo é refeito.
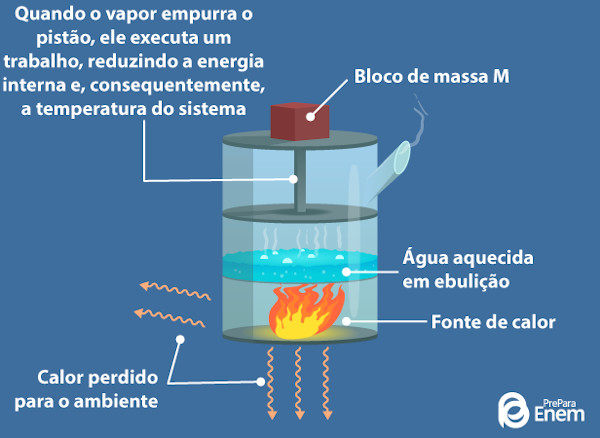
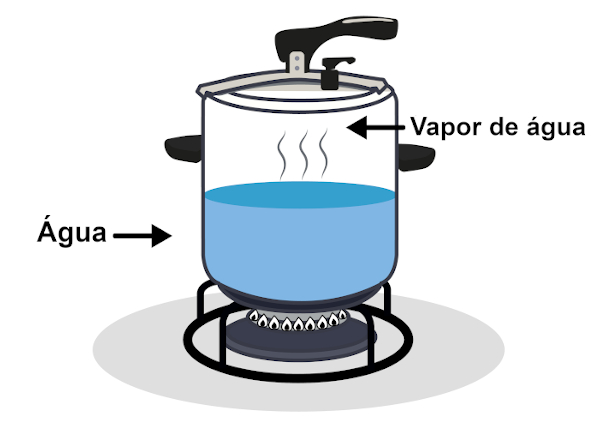
A panela de pressão também pode ser considerada um exemplo, já que o líquido dentro dela recebe calor e passa para o estado gasoso parcialmente. Por sua vez, o gás continua a receber calor, fazendo com que sua temperatura aumente. Como o recipiente é inflexível, a pressão aumenta dentro dele, e o excesso de vapor é liberado pela saída na parte superior da panela.
Acesse também: Como estudar Física para o Enem?
Exercícios resolvidos sobre Termodinâmica
Questão 1
Um gás estava contido em um recipiente cúbico. Esse recipiente era tampado por um êmbolo quadrado que, por sua vez, suportava um corpo de peso P. Enquanto o gás recebia calor, o êmbolo estava no limite do recipiente, porém quando a fonte de calor cessou, o calor começou a ser transferido para o ambiente em torno do cubo. Quando o gás perdeu 15 J de calor, sua variação de energia interna foi de 13,2 J. Considerando que o êmbolo desceu 3 cm, qual é o peso do conjunto êmbolo e corpo?
A) 50 N
B) 60 N
C) 80 N
D) 150 N
E) 20 N
Resolução:
Alternativa B
Como o gás perdeu calor para o meio, isso significa que tanto Q quanto ΔE serão negativos. Se um gás perde calor, sua temperatura será reduzida. Como sua temperatura é reduzida, o gás sofrerá uma contração, e consequentemente o valor trabalho será negativo.
Extraindo os dados do problema:
Q = -15 J
ΔE = -13,2 J
d = -3 cm (negativo, por ter ocorrido a contração do volume do gás)
P = ?
Primeiramente, o deslocamento deve ser convertido para metros, sendo dividido por 100.
\(d=-\frac{3 cm}{100}=-0,03\ m\)
\(∆E=Q-W\)
\(-13,2=-15-W\)
Invertendo ambos os lados da equação:
\(-15-W=-13,2\)
\(-W=-13,2+15\)
\(-W=1,8\ J\)
\(W=-1,8\ J\)
Como sua temperatura é reduzida, o gás sofrerá uma contração, e consequentemente o valor trabalho será negativo. Por definição, o trabalho é igual ao produto da força pelo deslocamento. Como a força envolvida no problema é a força peso:
\(W=F\cdot d=P\cdot d\)
\(-1,8=P\cdot(-0,03)\)
Invertendo ambos os lados da equação:
\(P\cdot(-0,03)=-1,8\)
\(P=\frac{-1,8}{-0,03}=60\ N\)
Questão 2
Uma máquina térmica foi construída para um experimento de Física. A fonte quente forneceu o equivalente a 400 J de calor, fazendo com que a máquina operasse com um rendimento de 80%. Após a análise dessas informações, marque a alternativa que representa a quantidade de calor fornecida para a fonte fria.
A) 80 J
B) 56 J
C) 695 J
D) 87 J
E) 150 J
Resolução:
Alternativa A
Extraindo os dados do problema:
Qc = 400 J
η = 80%
QF = ?
\(η=\frac{W}{Q_c}\cdot100\%\)
\(80\%=\frac{W}{400}\cdot100\%\)
Eliminando os zeros entre 100 e 400:
\(80\%=\frac{W}4\cdot1\%\)
Eliminando as porcentagens de 80% e 1%:
\(80=\frac{W}4\cdot1\)
1 não será repetido, já que está multiplicando por W, e serão invertidos ambos os lados da equação:
\(\frac{W}4=80\)
\(W=80\cdot4=320\ J\)
\(Q_C=W+Q_F\)
\(400=320+Q_F\)
Invertendo os dois lados da equação:
\(320+Q_F=400\)
\(Q_F=400-320\)
\(Q_F=80\ J\)