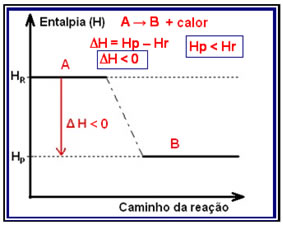
A variação da entalpia (?H) em uma reação consiste na diferença dada pela entalpia final, ou entalpia dos produtos, pela entalpia inicial, que é a entalpia dos reagentes (Hf – Hi ou HP – HR).
Em reações exotérmicas (exo significa “para fora”), em que há liberação de calor, a energia total do sistema diminuirá. Isso significa que a entalpia dos produtos será menor que a entalpia dos reagentes (HP < HR), portanto, a variação da entalpia será negativa (?H < 0).
Esse tipo de reação pode ter sua variação da entalpia demonstrada por meio de um gráfico que segue o modelo abaixo:
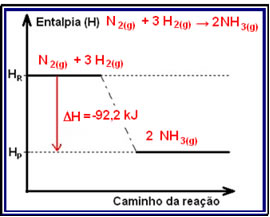
Um exemplo de reação exotérmica é a síntese da amônia, mostrada abaixo e representada no diagrama:
N2(g) + 3 H2(g) → 2 NH3(g) ?H = -92,2 kJ
Em reações endotérmicas (endo significa “para dentro”), em que há absorção de calor, a energia total do sistema aumentará. Isso significa que a entalpia dos produtos será maior que a entalpia dos reagentes (HP > HR), portanto, a variação da entalpia será positiva (?H > 0).
O diagrama que representa esse tipo de reação pode ser visto abaixo:
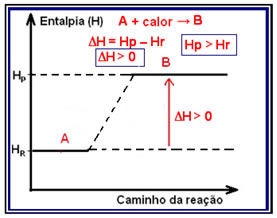
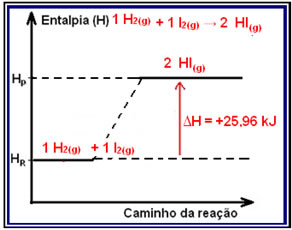
Um exemplo de reação endotérmica, que pode ter sua variação de entalpia demonstrada por meio de um diagrama, é a síntese do iodeto de hidrogênio:
1 H2(g) + 1 I2(g) → 2 HI(g) ?H = +25,96 kJ
Videoaulas relacionadas: