No texto Lei de Hess, foi explicado que a variação da entalpia (∆H) de uma reação química depende somente do estado inicial e final, e não de quantas etapas a reação passa.
Mas como podemos aplicar essa lei ao resolver problemas envolvendo equações termoquímicas e cálculos da variação de entalpia?
Bem, a Lei de Hess permite-nos determinar o valor de ∆H para reações diretas em que não é possível determinar esse valor experimentalmente. Essas reações nem sempre são exequíveis em laboratório e, portanto, não é possível determinar com exatidão o seu ∆H.
Assim, aplicando a Lei de Hess, se tivermos outras equações nas condições-padrão, que podem ser somadas e dar a reação direta que queremos, e se para essas equações soubermos os valores de ∆H, eles podem ser somados para resultar no valor da variação de entalpia da equação que queremos.
Para isso, precisamos seguir algumas regras:
1. Podemos inverter as equações termoquímicas com a finalidade de que as substâncias nos reagentes e nos produtos sejam as mesmas da equação-problema. Mas quando isso for realizado, precisamos inverter também o valor do ∆H, ou seja, o número permanecerá o mesmo, mas os sinais serão trocados (se for positivo, ficará negativo; e vice-versa). Isso deve ser feito porque se, por exemplo, em determinado sentido a reação liberar calor (∆H negativo), no sentido oposto, a reação deverá absorver (∆H positivo) a mesma quantidade de calor que havia liberado; o contrário também é verdadeiro;
2. Para igualar os coeficientes estequiométricos das substâncias iguais que aparecem nos reagentes e nos produtos, podemos multiplicar ou dividir para chegar ao valor que queremos. No entanto, lembre-se de que, ao multiplicar ou dividir, temos que fazer isso com todos os coeficientes da equação e também com o valor de ∆H;
3. Se temos a mesma quantidade de uma mesma substância no reagente de uma das equações e no produto de outra equação, ou seja, em membros opostos, a soma dessas substâncias será igual a zero, elas anulam-se;
4. Se uma substância aparece no reagente em uma equação e no produto em outra equação, mas as suas quantidades são diferentes, temos que diminuir os seus coeficientes e colocar a substância no membro que tem uma maior quantidade dessa substância;
5. Se temos a mesma substância nos reagentes ou nos produtos de duas ou mais reações, ou seja, se elas estiverem no mesmo membro, podemos somar seus coeficientes.
Veja um exemplo:
(UFSC) As seguintes equações termoquímicas são
CH4(g) + Cℓ2(g) → CH3Cℓ(g) + HCℓ(g) ΔH= - 109 kJ
CH3Cℓ(g) + Cℓ2(g) → CH2Cℓ2(g) + HCℓ(g) ΔH= - 96 kJ
CH2Cℓ2(g) + Cℓ2(g) → CHCℓ3(g) + HCℓ(g) ΔH= - 104 kJ
CHCℓ3(g) + Cℓ2(g) → CCℓ4(g) + HCℓ(g) ΔH= - 100 kJ
Qual a variação de entalpia (k Joule) correspondente à obtenção de 1 mol de cloreto de metila (CH3Cℓ), a partir de tetracloreto de carbono e cloreto de hidrogênio, quando reagentes e produtos forem gases a 25°C e 1 atmosfera de pressão?
CCℓ4(g) + 3 HCℓ(g) → CHCℓ3(g) + 3 Cℓ2(g)
Resolução:
Para chegar ao valor de ∆H para a reação acima, temos que trabalhar com o conjunto de equações que foi dado com os valores respectivos de ∆H. Mas não precisaremos usar a primeira equação. Por que não? Bem, ela possui o metano (CH4), que é uma substância que não aparece nas demais equações e nem na nossa equação-problema.
Agora observe que na equação-problema temos o CCℓ4(g) e o HCℓ(g) nos reagentes, e o CHCℓ3(g) e o Cℓ2(g) nos produtos, então vamos inverter todas as três equações. Lembrando de inverter o sinal do ∆H também:
II- CH2Cℓ2(g) + HCℓ(g) → CH3Cℓ(g) + Cℓ2(g) ΔH= + 96 kJ
III- CHCℓ3(g) + HCℓ(g) → CH2Cℓ2(g) + Cℓ2(g) ΔH= + 104 kJ
IV- CCℓ4(g) + HCℓ(g) → CHCℓ3(g) + Cℓ2(g) ΔH= + 100 kJ
Agora vamos somar as equações, anulando aquelas substâncias que estão em lados opostos e com a mesma quantidade:
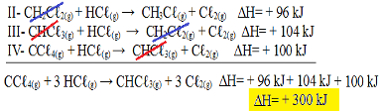
Aplicação da Lei de Hess em equações termoquímicas
Obtivemos exatamente a equação que estávamos desejando. Somando os calores envolvidos em cada reação, chegamos ao valor do ∆H da equação total, que é + 300 kJ/ mol de CHCℓ3(g). Nesse caso, não foi necessário multiplicar ou dividir as reações para igualar os coeficientes.