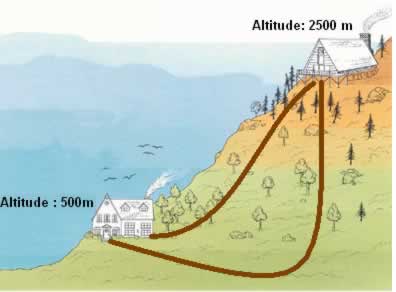
A Lei de Hess diz que a quantidade de calor liberada ou absorvida numa reação química depende somente dos estados inicial e final da reação. A quantidade de calor não depende do caminho da reação.
Por exemplo, a combustão do grafite pode ocorrer de duas maneiras diferentes:
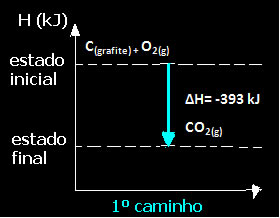
(1º) Foi realizada em uma única etapa:
C(grafite) + O2(g) → CO2(g) ∆H= -393 kJ
(2º) Foi realizada em duas etapas:
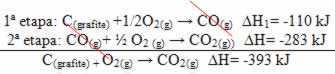
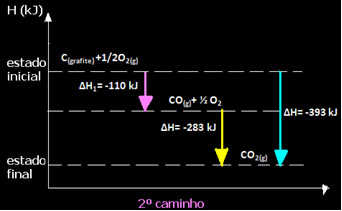
Observe que independente do caminho seguido pela reação – se foi apenas em uma ou em mais etapas – a variação da entalpia (∆H) final da reação foi a mesma (∆H= -393 kJ).
Quem observou isso pela primeira vez e criou essa lei que estamos estudando foi o químico suíço Germain Henri Hess, em 1840.

Essa lei foi muito importante, pois com ela é possível calcular as entalpias de reações que, de modo experimental, seriam difíceis de determinar. Por exemplo, se quisermos determinar a entalpia de uma reação que ocorre pelo caminho direto, pela Lei de Hess é só combinar várias outras reações intermediárias cujos valores sejam conhecidos e somá-las. Essa soma resulta no calor da reação desejada, como foi feito no exemplo acima.