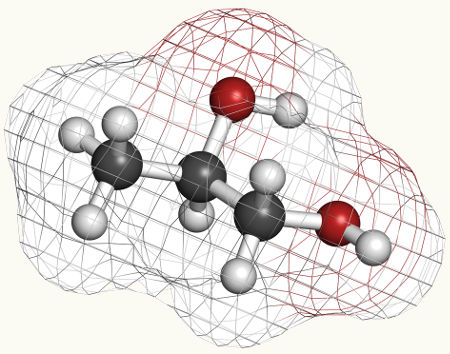
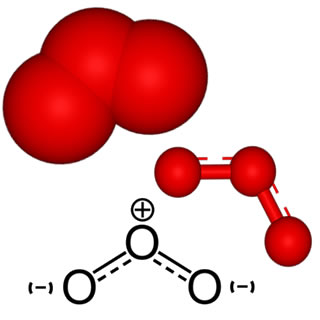
A oxidação branda em alcenos é uma reação orgânica em que um alceno (hidrocarboneto que apresenta uma ligação dupla entre os carbonos) é colocado na presença do regente de Baeyer (permanganato de potássio – KMnO4), em meio básico (mistura de água com uma base forte). Esse processo resulta sempre na formação de um diálcool vicinal, isto é, um álcool que apresenta duas hidroxilas, que estão em carbonos vizinhos.
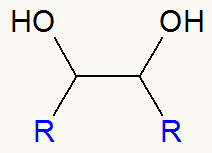
Esquema geral de um diálcool vicinal
A seguir vamos conhecer os componentes e como ocorre a oxidação branda em alcenos:
a) O reagente de Baeyer
A equação a seguir mostra o comportamento do reagente de Baeyer em meio básico:
2KMnO4(aq) → K2O(aq) + MnO2(ppt) + 3[O]
Quando o reagente de Baeyer é dissolvido em água com a presença de uma base, como o hidróxido de sódio (NaOH), acaba sofrendo decomposição e forma dois novos compostos (óxido de potássio - K2O e o dióxido de manganês - MnO2), além de liberar oxigênios nascentes ([O]).
Visualmente, quando o reagente de Baeyer é colocado em meio básico, temos a modificação da cor violeta (característica do permanganato de potássio) para uma solução incolor com a presença de um precipitado castanho, que é o dióxido de manganês.
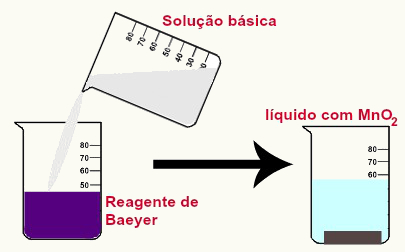
Representação da mudança de cor do reagente de Baeyer em meio básico
b) Influência do reagente de Bayer na oxidação de um alceno
Quando um alceno é adicionado a uma solução com reagente de Baeyer, água e base, a ligação pi entre dois átomos de carbonos do alceno é rompida. Com o rompimento, cada um desses dois carbonos passa a apresentar uma valência livre, ou seja, uma ligação a ser realizada:
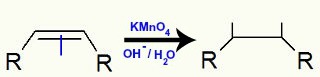
Rompimento da ligação pi e formação de valências livres na estrutura
Logo em seguida, as valências de cada carbono recebem um grupo OH, resultado da união de um oxigênio nascente com um hidrogênio da água:
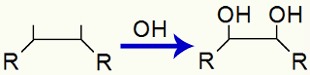
Ligação de grupos OH após o rompimento da ligação pi
Assim, após a oxidação branda do alceno, temos sempre a formação de um diálcool vicinal (dois carbonos próximos contendo grupo OH), como na estrutura abaixo:
.jpg)
Fórmula estrutural de um diálcool vicinal
c) Exemplos de oxidação branda em alcenos
Exemplo 1: Oxidação branda no propeno
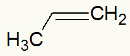
Fórmula estrutural do Propeno
Quando o propeno é adicionado a um meio básico com a presença do reagente de Bayer, ocorre o rompimento da ligação pi e formação de valências livres:
Rompimento da ligação pi e formação de valências no Propeno
Em seguida, dois grupos OH, formados pela associação do oxigênio nascente e do hidrogênio da água, ligam-se às valências livres:
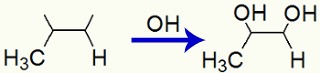
Interação de grupos OH nas valências livres criadas no Propeno
Por fim, temos um diálcool vicinal, chamado de propano-1,2-diol e formado por um grupo OH no carbono 1 e outro no carbono 2.
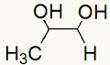
Fórmula estrutural do Propan-1,2-diol
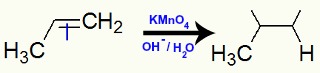
Exemplo 2: Oxidação branda no 2,3-dimetil-but-2-eno
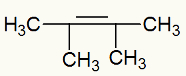
Fórmula estrutural do 2,3-dimetil-but-2-eno
Quando o 2,3-dimetil-but-2-eno é adicionado a um meio básico com a presença do reagente de Bayer, ocorre o rompimento da ligação pi e formação de valências livres:
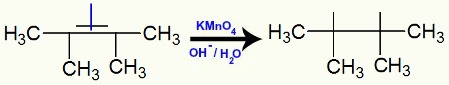
Rompimento da ligação pi e formação de valências no 2,3-dimetil-but-2-eno
Em seguida, dois grupos OH, formados pela associação de oxigênio nascente e o hidrogênio da água, ligam-se às valências livres:
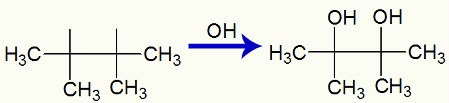
Interação de grupos OH nas valências livres criadas no 2,3-dimetil-but-2-eno
Por fim, temos um diálcool vicinal, chamado de 2,3-dimetil-butan-2,3-diol e formado por um grupo OH no carbono 1 e outro no carbono 2.
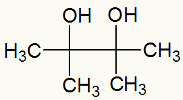
Fórmula estrutural do 2,3-dimetil-butan-2,3-diol