Os sais inorgânicos são compostos formados pela reação entre um ácido e uma base. O ácido fornece o ânion (espécie química carregada negativamente) e a base fornece o cátion (espécie química carregada positivamente) que formam o sal.
Assim, para saber quais são as fórmulas dos sais, é necessário conhecer quais são os íons que os formam. Em seguida, basta inverter as cargas dos íons pelos seus índices no sal. O índice é, na fórmula unitária, o número que vem subscrito (no canto inferior direito) do elemento ou do grupo de elementos, conforme mostrado a seguir:
CaCl2 → O índice do Ca é 1 (não é escrito) e o índice do Cl é 2.
Os índices indicam a quantidade mínima de átomos que se ligam aos átomos de outros elementos em uma fórmula unitária. No exemplo, são necessários dois cloros para estabilizar um átomo de cálcio.
Genericamente, a formulação de um sal pode ser representada da seguinte forma:
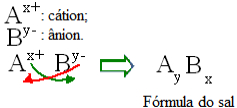
Regra genérica de construção das fórmulas dos sais
Veja que o valor da carga do cátion torna-se o índice do ânion, enquanto a carga do ânion torna-se o índice do cátion. Veja também que é somente o valor da carga que é invertido, os sinais negativos e positivos não vão para o índice.
Veja alguns exemplos de fórmulas de alguns sais:
Nitrato de potássio : K+ + NO3-: KNO3 (Observe que tanto o índice quanto a carga são iguais a “1”, logo, não precisam ser escritos);
Perclorato de potássio:K1+ + ClO41-: KClO4;
Sulfato de cálcio: Ca2+ + SO42-: CaSO4 (veja que, quando as cargas são iguais, podemos simplificar os índices. É por isso que a fórmula não é escrita assim: Ca2(SO4)2.
Dicromato de alumínio: Al3+ + Cr2O72-: Al2(Cr2O7)3;
Fosfato de bário: Ba2+ + PO43-: Ba3(PO4)2;
Nitrito de ferro III: Fe3+ + NO2-: Fe(NO2)3.
Outro ponto importante é que, na nomenclatura, o nome do ânion vem primeiro e o do cátion vem depois. Já na fórmula, a ordem é o contrário, ou seja, escreve-se primeiro o símbolo do cátion e depois o símbolo do ânion. Por isso, é muito importante saber as cargas dos íons. Mas e se você não tiver uma tabela de ânions e cátions, como fará para descobrir a sua carga?
Bem, no caso de íons formados por um único elemento, basta saber qual é a família do elemento na tabela periódica e seguir a regra do octeto para saber quanto elétrons ele precisa doar ou receber para ficar estável. Por exemplo, o cloro é da família 17 ou VII A, o que significa que ele tem sete elétrons na camada de valência. Segundo a regra do octeto, ele precisa ter oito elétrons na camada de valência para ficar estável. Então, ele precisa receber um elétron, formando assim o seguinte ânion: Cl-.
Seguindo essa regra, temos:
-Família 1 ou I A: cátion de carga 1+ (Exemplos: Na+, Li+, K+);
-Família 2 ou II A: cátion de carga 2+ (Exemplos: Ca2+, Ba2+, Mg2+);
-Família 3 ou III A: cátion de carga 3+ (Exemplo: Al3+);
-Família 15 ou V A: ânion de carga 3- (Exemplos: N3-, P3-, Sb3-);
-Família 16 ou VI A: ânion de carga 2- (Exemplos: O2-, S2-);
-Família 17 ou VII A: ânion de carga 1- (Exemplos: Cl-, F-, Br-, I-).
Agora, se tivermos os chamados íons compostos, a carga dos ânions será resultado da quantidade de elétrons que faltar para que os átomos fiquem estáveis. No caso dos cátions, será a quantidade de elétrons a mais que está sendo compartilhada em vez da que seria compartilhada normalmente.
Vamos ver dois exemplos de ânions compostos e depois dois exemplos de cátions compostos:
1º Exemplo: ânion fosfato: PO43-.
O fósforo (P) é da família 15, o que significa que ele tem cinco elétrons na camada de valência. Já o oxigênio é da família 16, por isso, apresenta seis elétrons na última camada eletrônica e precisa receber dois elétrons cada, o que dá um total de oito. Visto que o enxofre só possui cinco elétrons para poder doar ou compartilhar e os oxigênios precisam de oito, faltarão três elétrons. Por isso, a carga desse ânion é -3.
.jpg)
Estrutura do ânion fosfato
2º Exemplo: hidrogenossulfito: HSO3-.
O enxofre tem seis elétrons, pois é da família 16. Há também três átomos de oxigênio que precisam receber dois elétrons cada e um hidrogênio que precisa receber um elétron, dando um total de sete elétrons. Assim, faltará 1 elétron e, por isso, a carga desse ânion é -1.
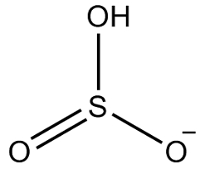
Estrutura do hidrogenossulfito
3º exemplo: hidrônio: H3O+.
O oxigênio só pode compartilhar dois elétrons para ficar estável, mas há três hidrogênios ligados a ele nesse caso. Isso significa que ele está compartilhando um elétron a mais do que deveria, por isso a carga desse cátion é +1.
.jpg)
Estrutura do cátion hidrônio
4º Exemplo: Amônio: NH4+.
O nitrogênio deveria realizar somente três ligações para ficar estável, mas ele está realizando quatro ligações com os átomos de hidrogênio. Assim, há 1 elétron a mais que está sendo compartilhado, por isso a carga desse cátion é +1.
.jpg)
Estrutura do cátion amônio