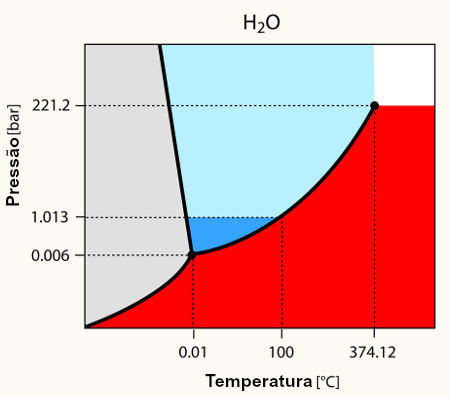
Denomina-se diagrama de fases um gráfico que apresenta três curvas, separando três áreas diferentes, tendo no eixo x a temperatura em graus Celsius (oC) e no eixo y a pressão, geralmente, em milímetros de mercúrio (mmHg).
Modelo de um diagrama de fases padrão para qualquer substância
Este gráfico é utilizado para determinar as condições de temperatura e pressão, necessárias para a mudança de estado físico de uma substância, ou senão para tê-la em um único estado físico.
Abaixo, temos as mudanças de estados físicos que podem ser analisados no diagrama de fases:
-
Fusão: passagem do estado sólido para o líquido.
-
Solidificação: passagem do estado líquido para o sólido.
-
Vaporização: passagem do estado líquido para o gasoso.
-
Condensação: passagem do estado gasoso para o líquido.
-
Sublimação: passagem do estado sólido para o gasoso.
-
Ressubilimação: passagem do estado gasoso para o sólido.
1- Características fundamentais de um diagrama de fases
Toda substância apresenta um diagrama de fases, semelhante ao modelo proposto:
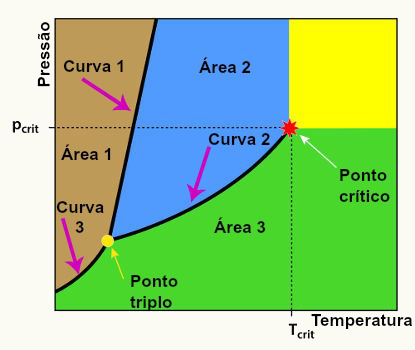
Modelo de um diagrama de fases contendo todos os seus componentes
Sendo que, neste diagrama de fases temos sempre os seguintes componentes:
-
Área 1: área que determina as condições de temperatura e pressão nas quais encontramos a substância no estado sólido,
-
Área 2: área que determina as condições de temperatura e pressão nas quais encontramos a substância no estado líquido,
-
Área 3: área que determina as condições de temperatura e pressão nas quais encontramos a substância no estado gasoso ou vapor,
-
Curva de solidificação (curva 1): curva que determina as condições de temperatura e pressão nas quais a substância pode sofrer fusão ou solidificação,
Não pare agora... Tem mais depois da publicidade ;) -
Curva de ebulição (curva 2): curva que determina as condições de temperatura e pressão nas quais a substância pode sofrer condensação ou vaporização,
-
Curva sublimação (curva 3): curva que determina as condições de temperatura e pressão nas quais a substância pode sofrer ressublimação ou sublimação.
-
Ponto crítico: é o ponto que determina as condições de temperatura e pressão nas quais podemos encontrar a substância apenas no estado gasoso.
-
Ponto triplo: é a região do diagrama de fases em que todas as curvas se encontram, determinando assim, a condição única de temperatura e pressão, na qual encontramos a substância, simultaneamente, nos três estados físicos (sólido, líquido e gasoso).
2- Exemplo de análise do diagrama de fases de uma substância específica
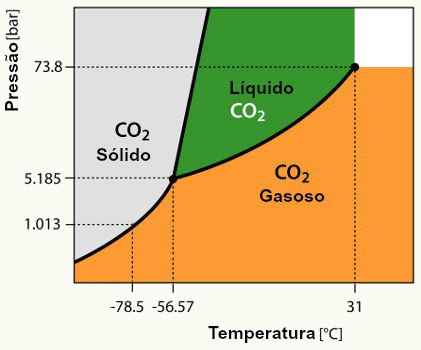
Diagrama de fases para o dióxido de carbono (CO2)
A partir do diagrama de fases do dióxido de carbono podemos determinar que:
-
A uma pressão de 5,185 bar e – 56,57oC, temos esta substância nos estados sólido, líquido e gasoso, ao mesmo tempo,
-
a partir de 73,8 bar 31 e 31oC, podemos encontrar o CO2 exclusivamente no estado gasoso,
-
Se mantivermos a temperatura em -78,5 oC, e variarmos a pressão de 1,013 a 73,8 bar, encontramos o CO2 exclusivamente no estado sólido,
-
A sublimação ou a ressublimação do CO2 é realizada em quaisquer valores de pressão e temperatura entre 1,013 a 5,185 bar, e -78,5 e -56,57 oC,
-
A fusão, solidificação, vaporização e condensação do CO2 podem ser realizadas em valores de pressão e temperatura entre 5,185 a 73,8 bar, -56,57 e 31 oC.
Videoaula relacionada: