Neste artigo aprenderemos como realizar cálculos estequiométricos quando os dados e a pergunta são expressos em termos de volume. Geralmente, considera-se o volume de gases em exercícios desse tipo e leva-se em consideração a Lei da combinação de volumes ou Lei volumétrica de Gay-Lussac, que diz o seguinte:
“Nas mesmas condições de temperatura e pressão, os volumes dos gases dos reagentes e dos produtos de uma reação química têm sempre entre si uma relação de números inteiros e pequenos.”
Portanto, se os gases envolvidos na reação estiverem nas mesmas condições de temperatura e pressão, poderemos usar a proporção dos coeficientes estequiométricos da equação química balanceada para relacionar com a proporção dos volumes dos gases.
Por exemplo, na reação abaixo, entre o gás hidrogênio e o gás cloro para a formação do gás cloreto de hidrogênio, a proporção estequiométrica é dada por 1 : 1 : 2:
1 H2(g) + 1 Cl2(g) → 2 HCl(g)
Isso significa que essa também será a proporção entre os volumes desses gases que reagirão, se eles estiverem na mesma temperatura e pressão:
1 H2(g) + 1 Cl2(g) → 2 HCl(g)
1 V 1 V 2 V
15 L 15 L 30 L
50 L 50 L 100 L
80 L 80 L 160 L
Assim, obedecendo a essas condições, os cálculos podem ser feitos diretamente, usando-se somente regras de três. Por outro lado, se os gases não estiverem nas mesmas condições, é preciso usar a relação estabelecida pela equação geral dos gases:
P1 . V1 = P2 . V2
T1 T2
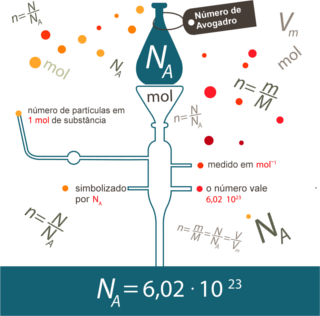
Além disso, é importante lembrar-se da Lei de Avogadro, que diz:
“Volumes iguais, de quaisquer gases, nas mesmas condições de temperatura e pressão, apresentam a mesma quantidade de matéria em mol ou moléculas.”
Por meio de vários experimentos, Avogadro constatou que 1 mol de qualquer gás, nas Condições Normais de Temperatura e Pressão (CNTP → 273 K e 1 atm), sempre ocupará o volume de 22,4L. Se estiver nas Condições Ambientais de Temperatura e Pressão (CATP), o volume molar passará a ser 25 L. E se estiver na STP (do inglês Standard Temperature and Pressure), o volume ocupado por 1 mol de qualquer gás será aproximadamente 22,71 L.
Veja três exemplos de exercícios de estequiometria envolvendo volume de gases e como essas informações são usadas para resolvê-los:
Exemplo 1: Considerando a reação
N2(g) + 3 H2(g) → 2 NH3(g)
quantos litros de NH3(g) são obtidos a partir de 3 litros de N2(g), considerando todos os gases nas CNTP?
Resolução:
Visto que todos os gases estão nas mesmas condições, basta usar as proporções entre os coeficientes e relacionar com a proporção entre os volumes por meio de regras de três:
N2(g) + 3 H2(g) → 2 NH3(g)
↓ ↓
1 volume de N2(g) produz 2 volumes de NH3(g).
1 L ----------- 2 L
3 L --------- V
V = 6 L de NH3(g).
Exemplo 2: (PUC-MG) Sob condições apropriadas, gás acetileno (C2H2) e ácido clorídrico reagem para formar cloreto de vinila, C2H3Cl. Essa substância é usada para produzir policloreto de vinila (P.V.C.) – plástico – e foi considerada recentemente carcinogênica. A reação na formação do C2H3Cl pode ser representada pela equação:
C2H2 + 1 HCl → C2H3Cl
Quando se obtêm 2 mol de cloreto de vinila, o volume de gás acetileno consumido, nas CNTP (0ºC e 1 atm), é igual a:
a) 11,2 L c) 33,6 L e) 89,2 L
b) 22,4 L d) 44,8 L
Resolução:
Nesse caso também temos todos os gases nas mesmas condições. Visto que estão nas CNTP, 1 mol de qualquer gás ocupa o volume de 22,4 L. Então podemos fazer a seguinte relação:
1 C2H2 + 1 HCl → 1 C2H3Cl
1 mol –------- 22,4 L
2 mol –------- V
v = 44,8 L.
A alternativa correta é a letra “d”.
Exemplo 3: O peróxido de bário se decompõe a altas temperaturas de acordo com a equação química:
2 BaO2(s) → 2 BaO(s) + O2(s)
Determine o volume de oxigênio liberado, a 27ºC e 1,00 atm, na decomposição térmica de 33,8 g de peróxido de bário, BaO2. Constante universal dos gases: R = 0,082 atm . L . mol-1 . K-1.
Resolução:
Primeiro descobrimos a massa molar:
MBaO2 = 137,3 . 1 + 16,0. 2 = 169,3 g/mol
Agora relacionamos a massa molar com o número de mol para descobrir a quantidade de matéria que reagiu:
1 mol –----- 169,3 g
n------------- 33,8 g
n = 33,8
169,3
n = 0,2 mol de BaO2(s)
Agora relacionamos com o volume nas CNTP:
1 mol –---- 22,4 L
0,2 mol –-- V
V = 4,48 L de BaO2(s)
Com o valor do volume de BaO2(s) que reagiu, podemos usar a equação geral dos gases para determinar o volume do oxigênio. Lembrando que o BaO2(s) está nas CNTP, em que a pressão é 1 atm e a temperatura é 273 K, enquanto o O2(g) está nas seguintes condições: a 27ºC e 1,00 atm. Então, temos:
PBaO2 . VBaO2 = PO2 . VO2
TBaO2 TO2
1 . 4,48 = 1 . VO2
273 300
273 . VO2 = 1344
VO2 = 1344
273
VO2 = 4,92 L
Esse seria o volume de O2(g) produzido se a proporção estequiométrica fosse de 1 : 1, ou seja, se fossem produzidos 2 mol de O2(g). Porém, a proporção dada pela equação química entre o BaO2(s) e o O2(g) é de 2 : 1, então, temos:
2 mol –---- 4,92 L
1 mol –----- VO2
VO2 = 2,46 L.
Videoaula relacionada: