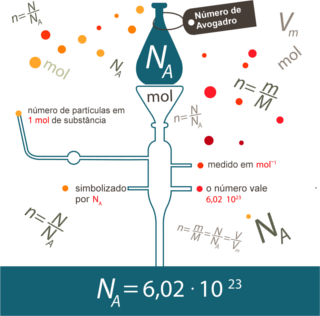
O texto “Cálculos Estequiométricos” explanou sobre o que a estequiometria faz no geral (calcula as quantidades das substâncias envolvidas em uma reação) e sobre os conceitos básicos que uma pessoa precisa saber para conseguir resolver exercícios de estequiometria, tais como saber escrever as equações que representam as reações químicas, balanceá-las, saber interpretar as fórmulas químicas, principalmente a molecular, e as relações mostradas abaixo:
.jpg)
Agora será explicado como resolver exercícios de cálculos estequiométricos em que os dados e a pergunta são expressos em massa, geralmente com a unidade em gramas.
Nesses casos, geralmente, seguem-se os dois passos a seguir:
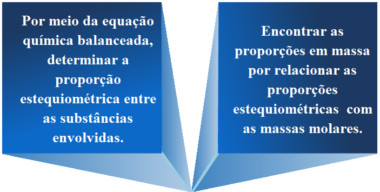
Consideremos um exemplo:
(ESPM-SP) O hipoclorito de sódio tem propriedades bactericida e alvejante, sendo utilizado para
cloração de piscinas, e é vendido no mercado consumidor em solução como Água Sanitária,
Cândida, Q-Boa etc. Para fabricá-lo, reage-se gás cloro com soda cáustica:
Cl2(g) + 2 NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
Qual é a massa de soda cáustica, NaOH(aq), necessária para obter 149 kg de hipoclorito de sódio, NaClO(aq)?
Dados: H= 1 u; O = 16 u; Na = 23 u; Cl = 35,5 u.
a) 40 kg.
b) 80 kg.
c) 12 kg.
d) 160 kg.
e) 200 kg.
Resolução:
O primeiro passo é sempre escrever a equação química e observar se ela já está balanceada. Nesse caso está. Então observamos qual é a proporção estequiométrica das substâncias que estamos analisando, isto é, a soda cáustica e o hipoclorito de sódio
Cl2(g)+ 2 NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
↓ ↓
2 mol 1 mol
Agora calculamos as massas molares dessas substâncias para poder relacioná-las com a proporção estequiométrica:
MNaOH = 23 + 16 + 1 = 40 g/mol
MNaClO = 23 + 35,5 + 16 = 74,5 g/mol
2 . 40 kg de NaOH –------- 1 . 74,5 kg de NaClO
z------------------–----------- 149 kg de NaClO
74,5 z = 80 . 149
z = 11920 / 74,5
z = 160 kg de NaOH
A resposta é a alternativa “d”.
Videoaula relacionada: