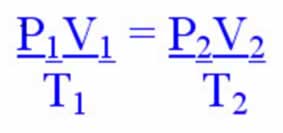Cálculos com a equação geral dos gases são realizados sempre que há a necessidade de determinar um novo estado de um gás, ou seja, uma nova variável, como pressão, volume ou temperatura, a partir da modificação de duas dessas variáveis.
Se o volume de um gás é modificado junto com a sua temperatura, por exemplo, é possível determinar a nova pressão a que ele está submetido por meio da equação geral do gases, descrita a seguir:
P1.V1 = P2.V2
T1 T2
Nessa equação:
-
T1 = temperatura no momento 1;
-
T2 = temperatura no momento 2;
-
P1 = pressão no momento 1;
-
P2 = pressão no momento 2;
-
V1 = volume no momento 1;
-
V2 = volume no momento 2.
Quando realizamos cálculos com a equação geral dos gases, as variáveis pressão, volume e temperatura devem apresentar, respectivamente, as mesmas unidades de medida. A temperatura é a única variável que apresenta unidade de medida obrigatória, que é dada em Kelvin.
A seguir, acompanhe alguns exemplos de cálculos com a equação geral dos gases:
1º Exemplo - (UFJF-MG) Em um laboratório de Química (pressão = 600 mmHg e temperatura = 300 K), foi realizada uma reação entre magnésio metálico e ácido clorídrico, na qual foram produzidos 30 mL de gás hidrogênio. Se aumentássemos a pressão para 800 mmHg e aquecêssemos o sistema a uma temperatura de 400 K, o volume de hidrogênio produzido corresponderia a:
a) 30 mL;
b) 120 mL;
d) 40 mL;
e) 20 mL.
Os dados fornecidos pelo exercício foram:
-
Volume 1= 30 mL
-
Volume 2 = ?
-
Pressão 1= 600 mmHg
-
Pressão 2 = 800 mmHg
-
Temperatura 1 = 300 K
-
Temperatura 2 = 400 K
P1.V1 = P2.V2
T1 T2
600.30 = 800. V2
300 400
300.800V2 = 600.30.400
240000 V2= 7200000
V2= 7200000
240000
V2= 30 mL
2º Exemplo - (UnB-DF) Certa massa de hidrogênio ocupa um volume de 100 cm3 a –73 oC e 5 atm. Calcular, em oC, a temperatura necessária para que a mesma massa de hidrogênio ocupe um volume de 1 L a 760 mmHg.
Os dados fornecidos pelo exercício foram:
-
Volume 1= 100 cm3 ou 0,1 L
-
Volume 2 = 1 L
-
Pressão 1= 5 atm
-
Pressão 2 = 760 mmHg ou 1 atm (já que a outra está na unidade atm)
-
Temperatura 1 = - 73 oC ou 200 K (já que a temperatura deve ser trabalhada em Kelvin)
-
Temperatura 2 = ?
Para determinar a temperatura solicitada pelo execício, basta utilizar os dados fornecidos na equação geral dos gases:
P1.V1 = P2.V2
T1 T2
5.0,1 = 1.1
200 T2
0,5.T2 = 200.1.1
T2 = 200
0,5
T2 = 400 K
Por fim, devemos transformar o valor obtido na unidade Kelvin em °C. Para isso, basta subtrair o resultado encontrado por 273:
T2 = 400-273
T2 = 127 oC