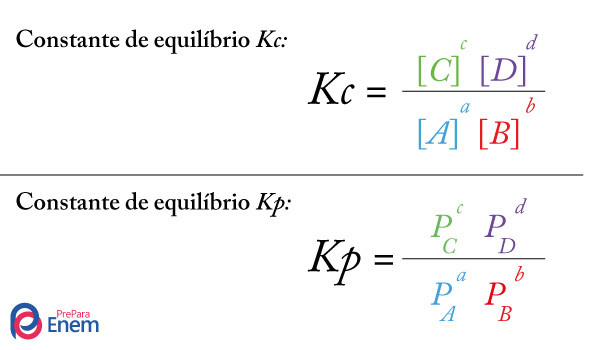O Princípio de Le Chatelier diz que, se um sistema estiver em equilíbrio e algum fator externo, como variação da concentração, da pressão ou da temperatura, acontecer; o sistema deslocará o equilíbrio químico a fim de minimizar as perturbações causadas.
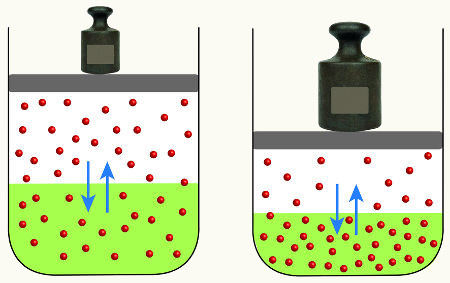
Analisemos, então, como a variação da pressão desloca o equilíbrio químico de uma reação reversível:
Variação da pressão em um sistema em equilíbrio:
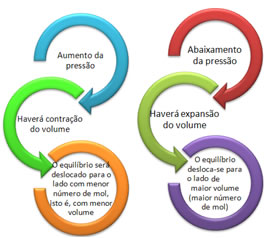
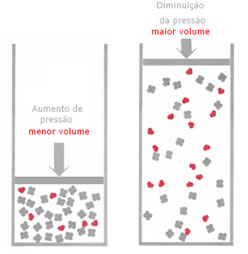
Se em um equilíbrio gasoso for aumentada a pressão, sem variar a temperatura, haverá um deslocamento no sentido da reação que diminuir a pressão e vice-versa. Associando o mol com o volume, temos a seguinte generalização:
Por exemplo, na reação abaixo, o volume (quantidade de matéria em mol) é maior no reagente.
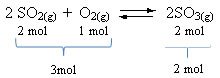
Se a pressão for aumentada, o deslocamento do equilíbrio se dará no sentido do menor volume que é para a direita, pois no produto temos apenas 2 mols de gás ocupando o volume, enquanto que no reagente o número é de 3 mols.
Portanto, se diminuirmos a pressão, ocorrerá o contrário do que foi visto anteriormente: o deslocamento do equilíbrio será no sentido de maior volume, ocorrendo, portanto, um deslocamento do sentido da reação inversa.
Para que esse deslocamento do equilíbrio com a variação da pressão seja observado, alguns fatores devem ser levados em consideração:
- O sistema deve ser gasoso;
- Os volumes dos reagentes e dos produtos devem ser diferentes;
- Um gás inerte adicionado no sistema não desloca o equilíbrio. Apesar de ele aumentar a pressão total do sistema, o gás não alterará as pressões parciais dos gases. Além disso, ele não varia a concentração dos participantes da reação.