Reações irreversíveis são aquelas que ocorrem por completo, ou seja, até que pelo menos um dos reagentes seja completamente consumido. Um exemplo claro é o da imagem acima, a combustão ocorre até que o fogo consuma toda a folha de papel, daí então só restam as cinzas. O papel não volta ao estado inicial.
Nas reações reversíveis acontece exatamente o contrário, as reações direta e inversa ocorrem simultaneamente. Os reagentes se convertem em produtos e estes podem retornar à forma inicial. A reação reversível pode ocorrer tanto em processos químicos como em físicos.
Mas o que reações reversíveis têm a ver com Equilíbrio químico? Só através delas é possível equilibrar um sistema.
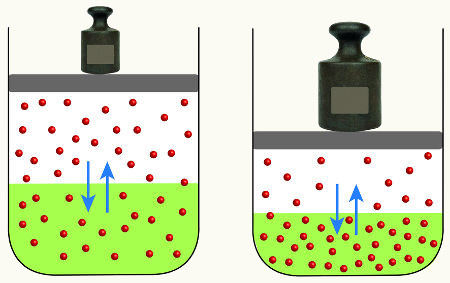
Um exemplo prático vai nos ajudar a entender melhor esta relação. Imagine um recipiente de vidro fechado contendo em seu interior um líquido volátil. O líquido se volatiliza até certo ponto e depois começa a se converter ao seu estado inicial. Isto é possível se este líquido for água.
As moléculas de água líquida se evaporam dentro do recipiente e passam para o estado de vapor. Após algum tempo o vidro fica embaçado e cheio de gotículas de água na tampa. Neste instante ocorre a condensação: a água evaporada retorna para o estado inicial (líquido). Quando a velocidade de vaporização se iguala à de condensação, o sistema entra em equilíbrio.
A reação reversível ocorre através da equação:
H2O (l)  H2O (v)
H2O (v)
Não se esqueça! A presença da seta dupla caracteriza as reações reversíveis:

Conclusão: o Equilíbrio químico mantém os reagentes numa constante transformação. ?
Videoaulas relacionadas: