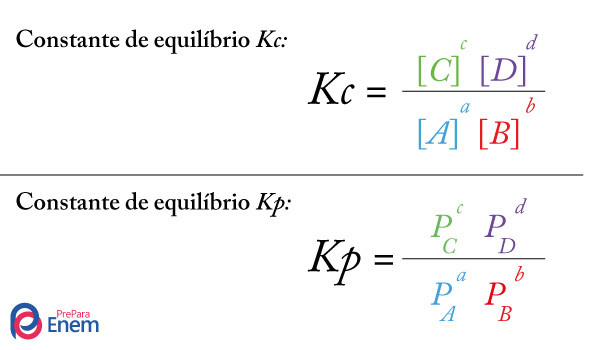Muitas reações ocorrem até que todo o produto seja consumido. Um exemplo é a queima do papel. Esse processo é considerado irreversível, pois o produto da reação não pode ser novamente transformado no reagente, que no caso é o papel.
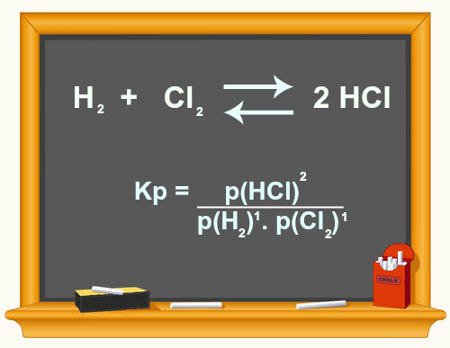
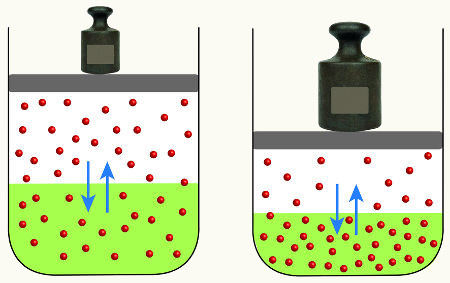
Mas existem outros casos de reações que são reversíveis, ou seja, as reações direta e inversa ocorrem simultaneamente. Quando as velocidades de ambos os sentidos da reação estão iguais, dizemos que o sistema está em Equilíbrio químico.