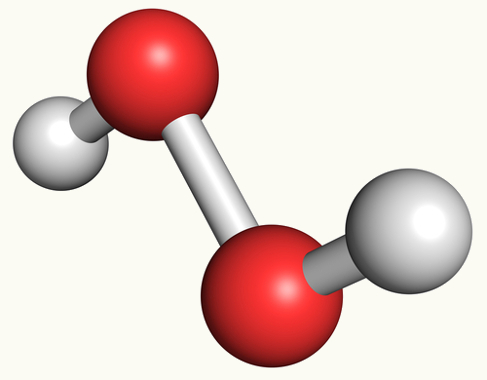
Os peróxidos, pertencente à classe dos óxidos, são substâncias que apresentam na sua composição dois elementos químicos, sendo assim chamados de compostos binários. Assim como os óxidos, um desses dois elementos é o oxigênio (elemento mais eletronegativo), porém nos peróxidos ele apresenta o nox igual a -1. De uma maneira geral os peróxidos podem ser classificados em iônicos ou moleculares.
Os iônicos são aqueles formados por elementos alcalinos, alcalino-terrosos ou ainda zinco e prata. Segue abaixo as fórmulas químicas de alguns desses peróxidos:
-
Ag2O2
-
Na2O2
-
K2O2
-
CaO2
-
MgO2
No caso dos moleculares, existe apenas um único peróxido molecular, que é o peróxido de hidrogênio, pelo fato de nenhum ametal formar um peróxido. A fórmula química do peróxido de hidrogênio é dada abaixo:
-
H2O2
OBS: Vale a pena ressaltar que em todas as formulações dos peróxidos temos a presença de dois átomos de oxigênio.
A nomenclatura destes compostos é feita de forma simples, utilizando a seguinte regra:
|
Peróxido + de + o nome do elemento que acompanha o oxigênio |
Você pode acompanhar abaixo os exemplos de alguns peróxidos com seus respectivos nomes:
-
Ag2O2 - Peróxido de prata
-
Na2O2 - Peróxido de sódio
Não pare agora... Tem mais depois da publicidade ;) -
K2O2 - Peróxido de potássio
-
CaO2 - Peróxido de cálcio
-
MgO2 - Peróxido de magnésio
-
H2O2 - Peróxido de hidrogênio
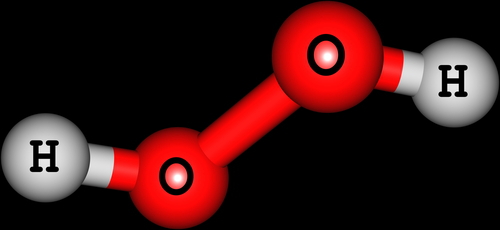
Representação de uma molécula de Peróxido de hidrogênio
Uma característica interessante dos peróxidos é a de que eles possuem caráter básico (iônicos), sendo que ao reagir com um ácido eles promovem a produção de um sal e de peróxido de hidrogênio. Veja um exemplo na equação representada a seguir:
H2SO4(aq) + K2O2(s)→ K2SO4 (aq)+ H2O2(aq)
Alguns peróxidos que apresentam utilizações importantes e interessantes são:
- Peróxido de magnésio (caracteriza-se por ser um sólido branco)
Utilizado para eliminar resíduos biológicos, diminuir a contaminação em águas subterrâneas e para calagem do solo.
- Peróxido de potássio (caracteriza-se por ser um sólido amarelo)
Ele é utilizado como alvejante e em equipamentos para respiração (utilizados em minas de extração, por mineiros, ou por bombeiros durante combate a incêndios).
- Peróxido de bário (caracteriza-se por ser um sólido cinza claro)
Utilizado na fabricação de ligas de bário e na pigmentação de fogos de artifício.
Videoaula relacionada: