No texto Crioscopia ou Criometriafoi visto que quando adicionamos um soluto não volátil num solvente, o seu ponto de congelamento diminui. Para calcularmosesse abaixamento, utilizamos a seguinte expressão:
∆tc = Kc . C . i
Em que:
∆tc = variação da temperatura de congelamento;
Kc = constante crioscópica específica para cada solvente;
C = molalidade;
i = fator de Van’t Hoff.
No caso da Ebulioscopia ou Ebuliometria, o ponto de ebulição aumenta e a mesma expressão pode ser usada para calcular a variação da temperatura de ebulição (∆te), sendo que a única diferença é que utilizaremos a constante ebulioscópica específica para cada solvente (Ke) no lugar da constante crioscópica:
Mas, o que significa esse fator de Van’t Hoff e como podemos chegar até ele?
O fator de Van’ t Hoff possui este nome em homenagem ao físico e químico holandês Jacobus Henricus Van’t Hoff (1852-1911). Esse fator é usado quando trabalhamos com soluções iônicas, em que a quantidade de partículas presentes na solução é maior do que o número de partículas do soluto que foram dissolvidas no solvente. Além disso, nem sempre ocorre uma ionização ou dissociação completa do soluto na solução, por isso, precisamos considerar um fator de correção, que é o fator de Van’ t Hoff (i).
Por exemplo, se adicionarmos o K3PO4 na água, ocorrerá a seguinte ionização:
1 K3PO4 → 3 K+ + 1 PO3-4
Veja que 1 mol de K3PO4 gerou 4 mol de íons na solução, sendo que o grau de ionização (α) foi 100% (α = 1). Assim, nesse caso, ié igual a 4.
Assim, temos que a relação entre o número total de partículas finais em relação às iniciais nas soluções iônicas é o fator de Van’t Hoff (i):

Por isso é que no caso anterior tivemos i= 4:
i = 4/1 = 4
Mas, e se o grau de ionização for igual a 80%, por exemplo?
Nesse caso, fazemos a conta considerando que foram dissolvidas 100 moléculas e que 80 se ionizaram, veja:
1 K3PO4 → 3 K+ + 1 PO3-4
No início: 100 moléculas → zero + zero
80% de moléculas ionizaram-se: 80 moléculas → ( 80 íons K+ . 3) + 80 íons PO3-4
No final, teremos: 100-80= 20 moléculas de K3PO4 → 240 íons K+ + 80 íons PO3-4
Desse modo, o cálculo do fator de Van’t Hoff é dado por:
i = 20 + 240 + 80 → i = 3,4
100
O cientista mencionado deduziu a fórmula que pode ser usada para calcular “i”:
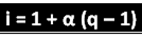
Em que qé a quantidade de íons gerados. Assim, seguindo o exemplo anterior, temos:
1 K3PO4 → 3 K+ + 1 PO3-4
α =80% = 0,8
q= 4 íons que foram gerados
Aplicando na fórmula:
i = 1 + α (q – 1)
i = 1 + 0,8 (4 – 1)
i = 1 + 3,2 – 0,8
i = 3,4