As reações de combustão são aquelas que ocorrem na presença de um combustível, que é qualquer material inflamável, e de um comburente, que é um material gasoso contendo gás oxigênio, O2, geralmente o ar.
É preciso também que haja uma fonte de ignição para dar início à reação, que pode ser uma chama ou uma faísca.
Uma grande variedade de compostos pode sofrer combustão, mas os que vamos considerar aqui, devido à sua importância na geração de energia, são os hidrocarbonetos, isto é, compostos orgânicos que contêm somente átomos de carbono e hidrogênio.
Quando esses compostos são os combustíveis, há duas possibilidades de combustões, podendo ser completas ou incompletas. Mas todas as reações de combustão liberam calor para o meio ambiente, isto é, são exotérmicas. O calor é usado para gerar energia e, por isso, é o principal “produto” desejado nas combustões.
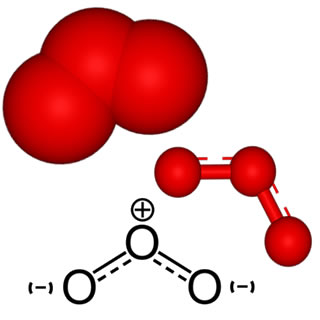
Além disso, toda combustão também é uma reação de oxirredução, pois o comburente, O2, sempre será o agente oxidante, sofrendo redução (seu Nox diminui) e o combustível é o agente redutor, sofre oxidação e seu Nox aumenta.
Veja como isso ocorre nas combustões completas e incompletas:
- Combustões completas: Os produtos formados sempre são dióxido de carbono (gás carbônico), CO2, e água, H2O. Há a ruptura da cadeia carbônica e a oxidação de todos os átomos de carbono presentes nas moléculas.

Por exemplo, o gás butano (C4H10) é um dos gases presentes no gás de cozinha que usamos para preparar os alimentos. Veja a equação da sua combustão completa abaixo:
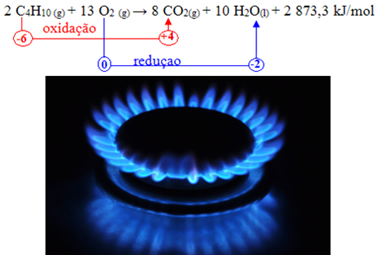
Observe que na combustão completa o carbono atinge o seu Nox máximo, +4.
Abaixo temos também a combustão incompleta de um hidrocarboneto, o isoctano, que é um dos componentes da gasolina:
C8H18(g) + 25/2 O2 (g) → 8 CO2(g) + 9 H2O(l)
Os derivados do petróleo, como a gasolina, são consumidos na maioria das vezes por meio de combustão para produzir energia. Visto que esse tipo de reação libera grande quantidade de CO2, a concentração desse gás tem aumentado cada vez mais na atmosfera, agravando o problema do efeito estufa e do aquecimento global.
.jpg)
- Combustões incompletas: Elas ocorrem quando não há oxigênio suficiente ou quando há um grande número de átomos de carbono no combustível, consumindo grande quantidade de oxigênio com muita rapidez.
Existem duas possibilidades de produtos para serem formados, dependendo da quantidade de oxigênio disponível, podendo ser monóxido de carbono (gás carbônico), CO2, e água, H2O; ou carbono (fuligem), C, e água, H2O.
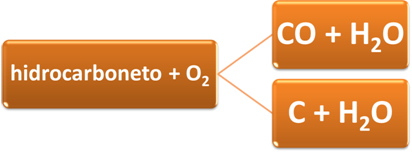
Exemplos de combustões incompletas:
2 C4H10 (g) + 9 O2 (g) → 8 CO(g) + 10 H2O(l)
2 C4H10 (g) + 5 O2 (g) → 8 C(s) + 10 H2O(l)
No primeiro caso, o Nox do combustível aumenta de -6 para +2, já no segundo caso, passa de -6 para 0, o que significa que oxida, mas não totalmente.
Veja também duas combustões incompletas do isoctano da gasolina:
C8H18(g) + 17/2 O2 (g) → 8 CO (g) + 9 H2O(l)
C8H18(g) + 9/2 O2 (g) → 8 C (s) + 9 H2O(l)
As reações incompletas geralmente são indesejadas, pois o CO é altamente tóxico e já causou a morte de pessoas em garagens mal ventiladas. É por isso que o motor do carro deve estar sempre bem regulado, para não produzir reações incompletas.
A fuligem pode ser vista na imagem abaixo, como uma fumaça escura, que algumas vezes sai de escapamentos de ônibus e caminhões. No entanto, industrialmente, a fuligem na forma de negro-de-fumo, um carvão finamente dividido, é desejado, pois ele é usado na fabricação da borracha de pneus e na produção de tintas, graxas de sapato, entre outros produtos.