Esse estudo é muito importante, visto que existem algumas reações que são muito rápidas e já outras muito lentas e talvez seja útil retardá-las ou acelerá-las, respectivamente.
Por exemplo, quando descascamos algumas frutas, como maçãs, peras e bananas, elas reagem com o oxigênio presente no ar e escurecem rapidamente. Para retardar esse processo é só acrescentar suco de laranja, pois a vitamina C tem mais afinidade com o oxigênio do que as substâncias presentes nessas frutas citadas. Além disso, guardamos alimentos na geladeira com essa finalidade: retardar sua reação de decomposição.
No entanto, em indústrias e no dia a dia é extremamente necessário acelerar algumas reações que ocorrem muito lentamente. Fazemos isso quando colocamos alimentos para cozinhar em panelas de pressão; e nas indústrias usam-se catalizadores. Outro exemplo é a conversão do monóxido de carbono liberado pelos escapamentos dos carros em dióxido de carbono. Essa reação é lenta e o monóxido de carbono é tóxico ao ser humano; assim, acelerar a sua conversão em dióxido de carbono é interessante.
Esses exemplos mostram que as reações podem ser extremamente lentas (como a formação de petróleo, que leva anos, séculos ou milênios) ou muito rápidas (como a explosão da pólvora).
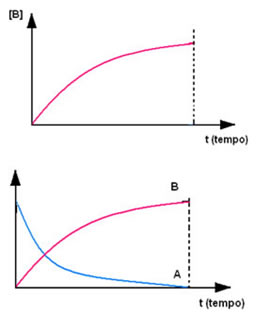
Na cinética química, as velocidades com que os reagentes são consumidos e com que os produtos são formados podem ser representadas por meio de gráficos. Por exemplo, considere uma reação genérica simples, em que todo o reagente é convertido no produto:
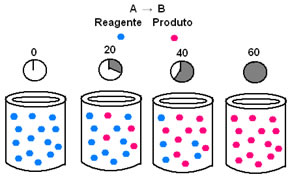
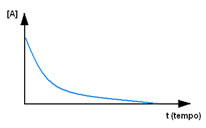
Observe primeiro o reagente A, que tem no instante inicial sua concentração ou quantidade máxima e, no decorrer do tempo, vai diminuindo até se tornar igual a zero, ou seja, até todo ele ser transformado no produto e a reação cessar. Isso é mostrado por meio do gráfico abaixo, em que a concentração da substância em questão é indicada pelo uso de colchetes []. Normalmente essa concentração é dada em mol/L ou molaridade:
O contrário ocorre com o produto B, que inicia com a concentração zero e, à medida que vai sendo formado, sua concentração aumenta até atingir o ponto máximo, quando a reação cessa e o reagente é totalmente consumido:
Aproveite para conferir as nossas videoaulas relacionadas ao assunto: